
 Ⅰ.某實驗小組對H2O2的分解做了如下探究.下表是該實驗小組研究H2O2分解速率的因素時記錄的一組數據,將質量相同但狀態不同的MnO2分別加入盛有15mL 5%的H2O2溶液的大試管中,并用帶火星的木條測試,結果如下:
Ⅰ.某實驗小組對H2O2的分解做了如下探究.下表是該實驗小組研究H2O2分解速率的因素時記錄的一組數據,將質量相同但狀態不同的MnO2分別加入盛有15mL 5%的H2O2溶液的大試管中,并用帶火星的木條測試,結果如下:| MnO2 | 觸摸試管情況 | 觀察結果 | 反應完成所需的時間 |
| 粉末狀 | 很燙 | 劇烈反應,帶火星的木條復燃 | 3.5min |
| 塊狀 | 微熱 | 反應較慢,火星紅亮但木條未復燃 | 30min |
分析 Ⅰ、(1)二氧化錳是過氧化氫分解的催化劑,由帶火星木條復燃,可知產物,由此可寫出方程式;由實驗現象可知,反應放熱還是吸熱;
(2)由實驗現象可知催化劑作用大小的影響因素.
Ⅱ、(1)化學方程式的系數之比等于各物質的物質的量的變化量之比;
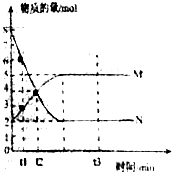
(2)根據v=$\frac{\frac{△n}{V}}{△t}$計算v(M);
(3)由圖可知,N為反應物,N的起始物質的量為8mol,平衡時參加反應的N的物質的量為8mol-2mol=6mol,在結合轉化率定義計算;
(4)當反應達到平衡狀態時,正、逆反應速率相等(同種物質),各物質的濃度、含量不再改變,以及由此衍生的一些物理量也不變,以此進行判斷.
解答 解:Ⅰ、(1)H2O2在二氧化錳作用下發生反應的化學反應方程式為:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,根據觸摸試管的感覺可知,該反應為放熱反應;
故答案為:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑; 放熱;
(2)因在其他條件相同時,粉末狀二氧化錳比塊狀二氧化錳反應所需時間短,說明接觸面積對反應速率有影響,
故答案為:接觸面積;
Ⅱ、(1)參加反應的N的物質的量為8mol-2mol=6mol,生成的M的物質的量是5mol-2mol=3mol,所以此反應的化學方程式中$\frac{a}{b}$=$\frac{2}{1}$,故答案為:$\frac{2}{1}$;
(2)由圖可知,t1到t2時刻M的物質的量變化為4mol-3mol=1mol,v=$\frac{\frac{(4-3)mol}{VL}}{({t}_{2}-{t}_{1})min}$═$\frac{1}{({t}_{2}-{t}_{1})V}$mol•L-1•min-1,故答案為:$\frac{1}{({t}_{2}-{t}_{1})V}$mol•L-1•min-1;
(3)由圖可知,N為反應物,N的起始物質的量為8mol,平衡時參加反應的N的物質的量為8mol-2mol=6mol,故N的轉化率為$\frac{6mol}{8mol}$×100%=75%,故答案為:75%;
(4)A.平衡時反應混合物各組分的物質的量不變,但各組分的物質的量不一定相等,故A錯誤;
B.混合氣體的總質量始終不變,混合氣體總質量不變不能說明到達平衡,故B錯誤;
C.由于a≠b,隨反應進行混合氣體總物質的量發生變化,混合氣體的總物質的量不隨時間的變化而變化,說明到達平衡,故C正確;
D.單位時間內消耗amolN,同時生成bmolM,都表示正反應速率,反應始終按此關系進行,不能說明到達平衡,故D錯誤;
E.由于a≠b,隨反應進行混合氣體總物質的量發生變化,混合氣體的壓強不隨時間的變化而變化,說明混合氣體總的物質的量再不變,說明反應到達平衡,故E正確;
故答案為:CE.
點評 本題考查化學反應速率計算、化學平衡計算、化學平衡狀態判斷,題目難度中等,注意把握由圖象判斷化學方程式的方法以及反應現象與結論的推斷.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:填空題
 以氮化鎵(GaN)為代表的第三代半導體材料目前已成為全球半導體研究的前沿和熱點.回答下列問題:
以氮化鎵(GaN)為代表的第三代半導體材料目前已成為全球半導體研究的前沿和熱點.回答下列問題: .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 實驗室用圖示裝置制取乙酸乙酯.
實驗室用圖示裝置制取乙酸乙酯.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 元素代號 | L | M | Q | R | T |
| 原子半徑/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合價 | +2 | +3 | +2 | +6、+4、-2 | -2 |
| A. | 與稀鹽酸反應的劇烈程度:L單質<Q單質 | |
| B. | M與T形成的化合物具有兩性 | |
| C. | 熱穩定性:H2T<H2R | |
| D. | L2+與R2-的核外電子數相等 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 放熱91.5 kJ | B. | 放熱183 kJ | C. | 吸熱183 kJ | D. | 吸熱91.5 kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Te與H2的反應比S與H2反應困難 | B. | TeO3對應的水化物是一種酸 | ||
| C. | H2Te的還原性比H2S弱 | D. | 有-2、+4、+6三種化合價 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Cl-、Br-、CrO42- | B. | CrO42-、Br-、Cl- | C. | Br-、Cl-、CrO42- | D. | Br-、CrO42-、Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗 編號 | 溫度 | 初始pH | 0.1mol/L草酸溶液/mL | 0.01mol/LKMnO4溶液體積/mL | 蒸餾水 體積/mL | 待測數據(反應混合液褪色時間/s) |
| ① | 常溫 | 1 | 20 | 50 | 30 | t1 |
| ② | 常溫 | 2 | 20 | 50 | 30 | t2 |
| ③ | 常溫 | 2 | 40 | 50 | 10 | t3 |
| 實驗方案(不要求寫出具體操作過程) | 預期實驗結果和結論 |
往反應混合液中加入少量MnSO4固體,控制其他反應條件與實驗①相同,進行對比實驗 | 若反應混合液褪色時間小于實驗①中的t1,則MnSO4對該反應起催化作用(若褪色時間相同,則MnSO4對該反應無催化作用) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com