
【題目】已知丁基有四種不同結構,則分子式為C5H10O2的羧酸的結構有( )
A.3種
B.4種
C.5種
D.6種
 口算題卡加應用題集訓系列答案
口算題卡加應用題集訓系列答案 綜合自測系列答案
綜合自測系列答案科目:高中化學 來源: 題型:
【題目】有機物對香豆酸( ![]() )主要用于配置香辛櫻桃、杏、蜂蜜等香料.
)主要用于配置香辛櫻桃、杏、蜂蜜等香料.
(1)寫出對香豆酸的分子式 .
(2)下列關于對香豆酸的說法不正確的是 .
a.能與NaOH溶液反應
b.能發生加成、取代、銀鏡反應
c.加金屬鈉,有氫氣生成
d.加FeCl3溶液,溶液顯紫色
(3)對香豆酸的某種同分異構體丁,可用于除草劑苯嗪草酮的中間體,其可通過下圖轉化關系制得. 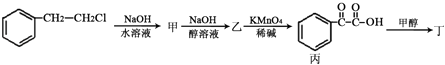
①乙→丙的反應類型;
②乙分子所含官能團是(填名稱);
③丙→丁的反應化學方程式:;
(4)有機物戊與丁互為同分異構體,且滿足以下特點:
①是苯的對位取代物,
②能與NaHCO3反應放出氣體,
③能發生銀鏡反應.
請寫出化合物戊的結構簡式(任寫一個即可).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乳酸亞鐵([CH3CH(OH)COO]2Fe·3H2O,Mr=288)是一種常用的補鐵劑,可通過乳酸與碳酸亞鐵反應制得:CH3CH(OH)COOH+FeCO3+2H2O―→[CH3CH(OH)COO]2Fe·3H2O+CO2↑。已知FeCO3易被氧化:4FeCO3+6H2O+O2===4Fe(OH)3+4CO2。某興趣小組用FeCl2(用鐵粉和稀鹽酸制得)和NH4HCO3制備FeCO3的裝置示意圖如下:
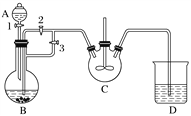
回答下列問題:
(1)NH4HCO3盛放在裝置__________(填字母)中,該裝置中涉及的主要反應的離子方程式________________________________________________________________________。
(2)將生成的FeCl2溶液和NH4HCO3溶液混合時的操作是____________________。
(3)將制得的FeCO3加入到足量乳酸溶液中,再加入少量鐵粉,75 ℃下攪拌反應。鐵粉的作用是________________________________________________________________________,反應結束后,無需過濾,除去過量鐵粉的方法是_________________________________.
(4)經查閱文獻后,該興趣小組用鈰(Ce)量法測定產品中Fe2+的含量。取2.880 g產品配成100 mL溶液,每次取20.00 mL,進行必要處理,用0.100 0 mol·L-1 Ce(SO4)2標準溶液滴定至終點,平均消耗Ce(SO4)2 19.70 mL。滴定反應如下:Ce4++Fe2+===Ce3++Fe3+,則產品中乳酸亞鐵的質量分數為______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】四氯化鈦是生產金屬鈦及其化合物的重要中間體。某校化學課外活動小組準備利用下圖裝置制備四氯化鈦{部分夾持儀器已略去)。

資料表明:室溫下,四氯化鈦為無色液體,熔點:-25℃,沸點:136.4℃。在空氣中與水蒸氣發生反應,形成發煙現象,生成二氧化鈦固體。在650~850℃下,將氯氣通過二氧化鈦和炭粉的混合物可得到四氯化鈦和一種有毒氣體。回答下列問題:
(1)A處分液漏斗上方的膠皮管的作用是_______;
(2)實驗中B裝置中選用的試劑為______,該裝置的作用是_________;
(3)D中物質制備的化學方程式為_________;
(4)E處球形冷凝管的作用是__________,該裝置冷卻水應從______(填“c”或“d")口通入;
(5)儀器F中盛裝的物質是__________;
(6)該實驗設計略有缺陷,請指出其不足之處: _________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖是一些常見單質、化合物之間的轉化關系圖,有些反應中的部分物質被略去。常溫常壓下,A為無色有毒氣體,B為紅棕色粉末,C、E為金屬單質,G、J的焰色均為黃色。反應①為煉鐵高爐中的重要反應;反應②可用于焊接鐵軌。
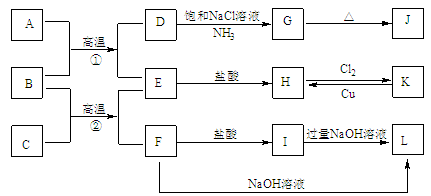
請回答下列問題:
(1)B的化學式為 ,J的化學式為 。
(2)工業上將氯氣通入石灰乳中制取漂白粉,該反應的化學反應方程式為 。
(3)D→G是侯氏制堿法的主要反應,該反應的化學方程式為 。
(4)K→H是制作印刷電路板的重要反應,該反應的離子方程式為 。
(5)F→L是鋁土礦提純中的重要反應,該反應的離子方程式為 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在氯水中存在多種分子和離子,它們在不同的反應中表現出各自的性質。下列實驗現象和結論一致且正確的是( )
A. 加入有色布條,一會兒有色布條褪色,說明溶液中有Cl2存在
B. 溶液呈淺黃綠色,且有刺激性氣味,說明有Cl2分子存在
C. 用鹽酸酸化后,滴入AgNO3溶液產生白色沉淀,說明氯水中有Cl-存在
D. 加入NaOH溶液,氯水黃綠色消失,說明有HClO分子存在
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于可逆反應N2(g)+3H2(g)2NH3(g)△H<0,下列研究目的和示意圖相符的是( )
A | B | C | D | |
研究目的 | 壓強對反應的影響(P2>P1) | 溫度對反應的影響 | 平衡體系增加N2對反應的影響 | 催化劑對反應的影響 |
圖示 |
|
|
|
|
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高純硅晶體是信息技術的重要材料。
(1)工業上用石英和焦炭可以制得粗硅。已知反應過程的能量變化如下圖


寫出用石英和焦炭制取粗硅的熱化學方程式______________________________。
(2)某同學設計下列流程制備高純硅:

①Y的化學式為____________________。
②寫出反應I的離子方程式________________________________________。
③寫出反應IV的化學方程式________________________________________。
④甲烷分解的溫度遠遠高于硅烷(SiH4),用原子結構解釋其原因______________________________。
(3)將粗硅轉化成三氯硅烷(SiHCl3),進一步反應也可以制得粗硅。其反應:SiHCl3(g)+H2(g) ![]() Si(s)+3HCl(g),不同溫度下,SiHCl3的平衡轉化率隨反應物的投料比的變化關系如圖所示。下列說法正確的是__________(填字母)。
Si(s)+3HCl(g),不同溫度下,SiHCl3的平衡轉化率隨反應物的投料比的變化關系如圖所示。下列說法正確的是__________(填字母)。

A.該反應是放熱反應
B.橫坐標表示的投料比可以是![]()
C.該反應的平衡常數隨溫度升高而增大
D.實際生產中為提高SiHCl3的利用率,可以適當增大壓強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向體積均為10 mL、物質的量濃度相同的兩份NaOH 溶液中分別通入一定量的CO2,得到溶液甲和乙。向甲、乙兩溶液中分別滴加0.1mol/L的鹽酸,此時反應生成CO2體積(標準狀況)與所加鹽酸體積的關系如圖所示。則下列敘述中不正確的是

A. 原NaOH溶液的物質的量濃度為0.5 mol/L
B. 當0鹽酸)<10 mL時,甲溶液中發生反應的離子方程式為H++CO32-=HCO3-
C. 乙溶液中含有的溶質是Na2CO3、NaOH
D. 向乙溶液中滴加過量鹽酸后產生CO2體積的最大值為224 mL
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com