
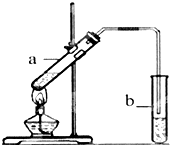
 葡萄可用于釀酒.
葡萄可用于釀酒.分析 (1)葡萄糖中含有醛基,能被新制的氫氧化銅懸濁液氧化,所以實驗現象是產生磚紅色沉淀;
(2)根據碳原子和氧原子守恒可知,另外一種生成物是CO2;
(3)①乙酸和乙醇在濃硫酸作用下發生酯化反應,生成乙酸乙酯和水;
②制備乙酸乙酯時常用飽和碳酸鈉溶液吸收乙酸乙酯,目的是除去乙醇和乙酸、降低乙酸乙酯的溶解度,便于分層;
③實驗開始時,試管b中的導管不伸入液面下的原因是防止倒吸;
④乙酸乙酯不溶于水,分液即可,需要用到的儀器是分液漏斗;
(4)有機物中,只有含有羧基的有機物可以和碳酸氫鈉反應產生二氧化碳氣體.
解答 解:(1)葡萄糖中含有醛基,能被新制的氫氧化銅懸濁液氧化,所以實驗現象是產生磚紅色沉淀氧化亞銅,
故答案為:磚紅色沉淀;
(2)根據碳原子和氧原子守恒可知,另外一種生成物是CO2,
故答案為:CO2;
(3)①在濃硫酸的作用下,乙醇和乙酸發生酯化反應生成乙酸乙酯,反應的化學方程式是CH3COOH+C2H5OH$?_{△}^{濃硫酸}$CH3COOC2H5+H2O.
故答案為:CH3COOH+C2H5OH$?_{△}^{濃硫酸}$CH3COOC2H5+H2O;
②由于乙醇和乙酸都是易揮發的,所以生成的乙酸乙酯中含有乙醇和乙酸,除去乙醇和乙酸的試劑是飽和的碳酸鈉溶液,
故答案為:碳酸鈉;
③由于乙醇和乙酸都是和水互溶的,如果直接插入水中吸收,容易引起倒吸,所以試管b中的導管不伸入液面下的原因是防止溶液倒吸.
故答案為:防止倒吸;
④乙酸乙酯不溶于水,分液即可,需要用到的儀器是分液漏斗,
故答案為b;
(4)有機物中,只有含有羧基的有機物可以和碳酸氫鈉反應產生二氧化碳氣體,驗證該有機物中含有-COOH官能團常采用的方法是加入NaHCO3,產生的現象為放出氣體,故答案為:加入NaHCO3;放出氣體.
點評 本題考查了葡萄糖的性質、乙酸乙酯制備實驗的有關探究,該題是基礎性實驗題的考查,試題緊扣教材,基礎性強,旨在培養學生靈活運用基礎知識解決實際問題的能力,有利于培養學生規范嚴謹的實驗設計能力.明確實驗原理,注意葡萄的結構和性質、碳酸鈉的作用,注意相關知識的積累和總結.


科目:高中化學 來源:2016-2017學年安徽師大附中高二上10月月考化學卷(解析版) 題型:選擇題
已知分解1 mol H2O2 放出熱量98KJ,在含少量I-的溶液中,H2O2的分解機理為:H2O2+I-→H2O +IO- 慢;H2O2+IO-→H2O+O2+I- 快,下列有關反應的說法正確的是
A.反應的速率與I-的濃度有關 B. IO-也是該反應的催化劑
C.反應活化能等于98KJ·mol-1 D.v(H2O2)=v(H2O)
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
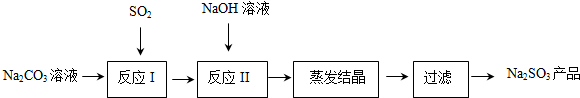
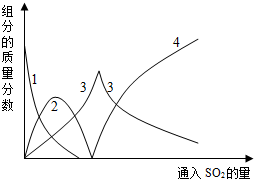
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
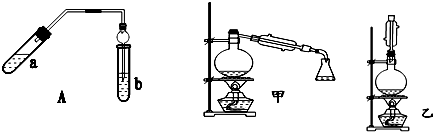
| 實驗編號 | 試管a中試劑 | 試管b中試劑 | 測得有機層的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL18mol•L-1 濃硫酸 | 飽和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol•L-1 H2SO4 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、鹽酸 | 1.2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
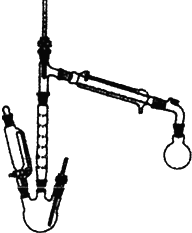 實驗室也可用如圖所示的裝置制取少量乙酸乙酯.(已知乙酸乙酯在水中的溶解度較大,15℃時100g水中能溶解8.5g)
實驗室也可用如圖所示的裝置制取少量乙酸乙酯.(已知乙酸乙酯在水中的溶解度較大,15℃時100g水中能溶解8.5g)查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
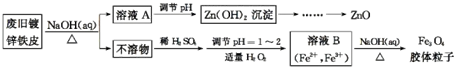
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
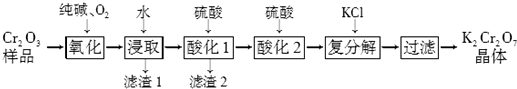
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
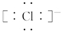 .Al在元素周期表最中的位置是第三周期第IIIA族.
.Al在元素周期表最中的位置是第三周期第IIIA族.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com