
分析 ①硫酸鋇不溶于酸;石膏能夠用來固定斷肢;無水硫酸銅與水反應生成五水硫酸銅;
②濃硫酸具有強氧化性和酸性,能夠與還原性氣體、堿性氣體發生反應;
③工業上以黃鐵礦(主要成分FeS2,雜質不含硫元素)為原料生產硫酸.其反應原理為:
①FeS2與O2高溫下反應生成SO2;
②SO2在催化劑作用下與O2反應生成SO3;
③SO3與H2O反應生成H2SO4;
④把碎石粉碎成粉末;通入過量的空氣,可以加快反應速率.
解答 解:①硫酸鋇不溶于酸,可以用來做鋇餐,化學式為:BaSO4;石膏能夠用來固定斷肢,化學式為:CaSO4•2H2O;無水硫酸銅與水反應生成五水硫酸銅,可以用來檢驗酒精中的水,化學式為:CuSO4;
故答案為:BaSO4;CaSO4•2H2O;CuSO4;
②濃硫酸具有強氧化性和酸性,能夠與還原性氣體、堿性氣體發生反應,所以濃硫酸不能干燥硫化氫氣體和氨氣;
故答案為:強氧化性;酸性;
③①FeS2與O2高溫下反應生成SO2,方程式為:4FeS2+11O2$\frac{\underline{\;高溫\;}}{\;}$2Fe2O3+8SO2;
②SO2在催化劑作用下與O2反應生成SO3,方程式為:2SO2+O2$\frac{\underline{\;催化劑\;}}{△}$2SO3;
③SO3與H2O反應生成H2SO4,方程式:SO3+H2O=H2SO4;
故答案為:2Fe2O3+8SO2;2SO2+O2$\frac{\underline{\;催化劑\;}}{△}$2SO3;SO3+H2O=H2SO4;
④把碎石粉碎成粉末;通入過量的空氣,可以加快反應速率,提高生產效率;
故答案為:把碎石粉碎成粉末;通入過量的空氣.
點評 本題考查了元素化合物知識,熟悉硫酸鋇、硫酸鈣、硫酸銅的性質,熟悉硫鐵礦制備硫酸的反應過程是解題關鍵,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | X的電負性大于Y的電負性 | B. | X的原子半徑大于Y的原子半徑 | ||
| C. | X的氧化性大于Y的氧化性 | D. | X的第一電離能大于Y的第二電離能 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 負極反應:H2-2e-═2 H+ | |
| B. | 通O2的一極是發生還原反應 | |
| C. | 工作一段時間后電解質溶液的c(OH-)增大 | |
| D. | 工作時負極區附近pH增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 硫在氧氣中燃燒 | B. | 硫化氫在氧氣中燃燒 | ||
| C. | 鐵粉與硫粉混合加熱 | D. | 銅在空氣中加熱 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 化學反應必伴隨能量變化 | |
| B. | 反應是放熱還是吸熱須看反應物和生成物具有的總能量的相對大小 | |
| C. | Ba(OH)2•8H2O和NH4Cl(固體)混合攪拌發生的是吸熱反應 | |
| D. | 燃煤發電不需經過其它能量轉換過程,可直接把化學能轉化為電能 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應所生成的氣體體積:a杯>b杯 | B. | 反應所需要的時間:a杯>b杯 | ||
| C. | 剛開始時反應的速率:b杯>a杯 | D. | 整個反應階段平均速率:a杯>b杯 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 食物放在冰箱里 | B. | 在糕點包裝內放置小包除氧劑 | ||
| C. | 燃煤發電時用煤粉代替煤塊 | D. | 塑料制品中添加抑制劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 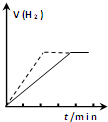 向一定質量的鋅與過量的稀硫酸反應的試管中加入少量的CuSO4溶液,如圖虛線表示加入CuSO4溶液時氫氣體積與時間的關系 | |
| B. | 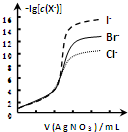 用0.0100mol/L硝酸銀標準溶液,滴定濃度均為0.1000mol/LCl-、Br-及I-的混合溶液,由圖曲線,可確定首先沉淀的是Cl- | |
| C. | 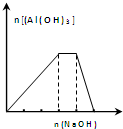 向NH4Al(SO4)2溶液中滴加過量的NaOH溶液,圖中曲線表示NaOH的物質的量與Al(OH)3物質的量關系圖 | |
| D. | 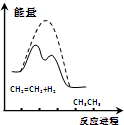 由圖可說明乙烯與H2加成反應是放熱反應,虛線表示在有催化劑條件下的反應進程 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com