
【題目】實驗研究發(fā)現(xiàn),硝酸發(fā)生氧化還原反應時,硝酸的濃度越稀,對應還原產物中氮元素的化合價越低.某同學取一定量的鋁鐵合金與100mL很稀的硝酸充分反應,反應過程中無氣體放出.在反應結束后的溶液中,逐滴加入4 mol/L的氫氧化鈉溶液,所加氫氧化鈉溶液的體積(mL)與產生的沉淀的物質的量(mol)的關系如圖所示.試回答下列問題:
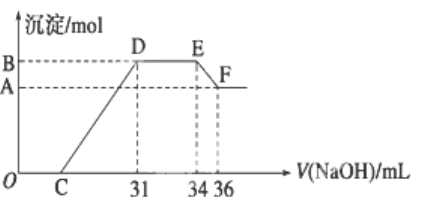
(1)結合OH-的能力最弱的是________(填離子符號)
(2)B與A的差值為________mol.
(3)原混合物中鋁粉與鐵粉的物質的量之比為______.
(4)B點對應的沉淀量為________mol,C點對應的溶液體積為________mL.
(5)硝酸溶液的物質的量濃度為_________mol·L-1
(6)寫出鋁與該濃度硝酸反應的離子方程式_____________________。
【答案】NH4+ 0.008 1:3 0.032 7 1.48mol·L-1 8Al+30H++3NO3-===8Al3++3NH4++9H2O
【解析】
鋁粉和鐵粉的混合物與100 mL很稀HNO3充分反應,被氧化為Al3+、Fe3+,反應始終沒有氣體生成,可知不會有氮的氧化物生成,根據(jù)題設條件可知,硝酸的濃度越稀,對應還原產物中氮元素的化合價越低,可以推測N元素在該反應過程中由+5價變成了較低的價態(tài)-3價,結合圖像可以看出硝酸過量,加入氫氧化鈉溶液應先與硝酸發(fā)生中和反應,再生成沉淀,當沉淀完全后,繼續(xù)加入氫氧化鈉溶液,沉淀量不變,則OH-與溶液中的NH4+發(fā)生了反應,再繼續(xù)滴加氫氧化鈉,氫氧化鋁沉淀被溶解,故結合圖像可分析出隨著氫氧化鈉的不斷滴加,溶液中發(fā)生的反應的依次為:OC段:H++OH- = H2O,CD段:Fe3++3OH- = Fe(OH)3↓,Al 3++3OH- = Al(OH)3↓,DE段:NH4++ OH-═NH3H2O,EF段:Al(OH)3+OH-=AlO2-+2H2O,據(jù)此分析作答。
(1)D與E一段沉淀的質量沒有發(fā)生變化,為NH4NO3和NaOH的反應,所以溶液中結合OH-的能力最弱的是NH4+,
故答案為:NH4+;
(2)E與F之間沉淀的量減少,因為Al(OH)3溶解在氫氧化鈉溶液中,反應的離子方程式為Al(OH)3+OH-=AlO2-+2H2O,則溶解的沉淀的物質的量(B與A的差值)等于EF階段消耗的氫氧化鈉的物質的量,為4 mol/L![]() (36 mL-34 mL)
(36 mL-34 mL)![]() 10-3 = 0.008 mol,
10-3 = 0.008 mol,
故答案為:0.008 mol;
(3)根據(jù)鋁元素守恒可知,設參與反應的鋁的物質的量為x mol,則
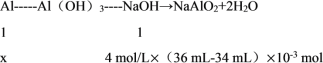
解得x = 0.008 mol,
即鋁的物質的量是0.008 mol;
又DE段是NH4NO3和NaOH反應,根據(jù)關系式NH4NO3~NaOH得n(NH4NO3)=n(NaOH)=(34-31)×10-3 L×4 mol/L = 0.012 mol,
設鐵有y mol,Al離子也是0.008 mol,NH4+有0.012 mol,根據(jù)電子轉移數(shù)守恒可得:
3x+0.008×3=0.012×8,
y = 0.024 mol,
所以鐵離子有0.024 mol,根據(jù)原子守恒知,鐵的物質的量是0.024mol,則原混合物中鋁粉與鐵粉的物質的量之比為0.008 mol:0.024 mol = 1:3,
故答案為:1:3;
(4)B為沉淀的最大值,沉淀為Al(OH)3和Fe(OH)3,根據(jù)元素守恒法可知,其物質的量分別為鋁粉和鐵粉的物質的量,為0.008 mol+0.024 mol = 0.032 mol;根據(jù)圖象確定C點消耗氫氧化鈉的量.滴加NaOH體積為31 mL時,
發(fā)生反應為①H++OH-=H2O,②Fe3++3OH-=Fe(OH)3↓,Al3++3OH-=Al(OH)3↓,
可計算得出C點氫氧化鈉溶液的體積為31 mL-![]() 103 mL/L = 7 mL,
103 mL/L = 7 mL,
故答案為:0.032 mol;7;
(5)E點時,溶液中的溶質是硝酸鈉和氨水,n(NH3H2O)=n(NH4+)=0.012 mol,n(NaNO3)=n(NaOH)= 34×10-3 L×4mol/L = 0.136 mol,根據(jù)氮原子守恒知,c(HNO3)=![]() =
= ![]() = 1.48 mol/L,
= 1.48 mol/L,
故答案為:1.48;
(6)根據(jù)題意可知,該濃度的硝酸與鋁反應時,得到的氮元素化合價為-3價,根據(jù)氧化還原反應的規(guī)律配平該離子方程式得,8Al+30H++3NO3-===8Al3++3NH4++9H2O,
故答案為:8Al+30H++3NO3-===8Al3++3NH4++9H2O。


科目:高中化學 來源: 題型:
【題目】按右下圖裝置進行實驗,下列描述正確的是(N裝置中兩個電極均為石墨棒)( )

A. C1上發(fā)生還原反應
B. M 裝置中SO42-移向Cu電極
C. 工作一段時間后裝置M 中溶液pH變小,裝置N中溶液pH變大
D. Cu電極與C2電極上的電極反應相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定條件下,1mol N2和3mol H2混合后反應,達到平衡時測得混合氣體的密度是同溫同壓下氫氣的5倍,則氮氣的轉化率為( )
A. 20% B. 30% C. 40% D. 50%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C分別代表中學化學中常見物質,請根據(jù)題目要求回答下列問題:
(1)實驗室常用A的飽和溶液制備微粒直徑為lnm-100nm的紅褐色液相分散系,則該反應的化學方程式為:_____,將A的溶液加熱蒸干并灼燒,得到固體的化學式為:_____。
(2)B為地殼中含量最高的金屬元素的氯化物,向50.0mL,6mol/L的B溶液中逐滴滴入100mL某濃度的KOH溶液,若產生7.8g白色沉淀,則加入的KOH溶液的濃度可能為____。
(3)將A、B中兩種金屬元素的單質用導線連接,插入一個盛有KOH溶液的燒杯中構成原電池,則負極發(fā)生的電極反應為:_______。
(4)C是常見溫室氣體,將一定量的氣體C通入100mL 某濃度的KOH得溶液F,向F溶液中逐滴加入2 molL-1的鹽酸,產生CO2的體積與所加鹽酸體積之間關系如圖所示。則F溶質與足量石灰水發(fā)生反應最多可得沉淀的質量為____g。
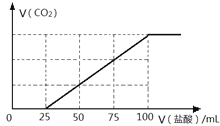
(5)pH = 3.6時,碳酸鈣與硫酸鋁反應可制備堿式硫酸鋁[Al2(SO4)x(OH)6-2x]溶液。若溶液的pH偏高,則堿式硫酸鋁產率降低且有氣體C產生,用化學方程式表示其原因_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】①Cu絲 ②Cl2 ③Al2(SO4)3溶液 ④蔗糖 ⑤濃硝酸⑥Ca(OH)2⑦NH4Cl⑧CO2 ⑨氨水
請用以上相應的數(shù)字編號和化學用語回答問題:
(1)屬于電解質的是__________;屬于非電解質的是__________.
(2)實驗室制取氨氣的化學反應方程式_______________________.
(3)工業(yè)制漂白粉的化學反應方程式__________________________.
(4)實驗室制Al(OH)3的離子方程式______________________________________________________
(5)①和⑤的化學方程式并用雙線橋標出電子轉移__________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,將2molA和3molB充入一密閉的容器中發(fā)生反應:aA(g)+B(g)![]() C(g)+D(g),5 min后達平衡。已知該反應在此溫度下平衡常數(shù)K=1,若溫度不變的情況下將容器的體積擴大為原來的10倍,A的轉化率不發(fā)生變化,則
C(g)+D(g),5 min后達平衡。已知該反應在此溫度下平衡常數(shù)K=1,若溫度不變的情況下將容器的體積擴大為原來的10倍,A的轉化率不發(fā)生變化,則
A. a="3" B. a="2" C. B的轉化率為40% D. B的轉化率為60%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】葡萄酒常用焦亞硫酸鈉(Na2S2O5)作抗氧化劑。某興趣小組用下圖裝置(夾持裝置略)測定某葡萄酒中抗氧化劑的殘留量(以游離的SO 2計算),方案如下:向B中加入300.00mL葡萄酒和適量的稀硫酸,加熱使SO2全部逸出并與C中H2O2完全反應,除去C中過量的H2O2后,將C中液體轉移至小燒杯中,向燒杯內逐滴加入BaCl2溶液至沉淀量不再增加,過濾出沉淀,經洗滌、干燥后,稱得固體的質量為0.2796g,則該葡萄酒中SO2的含量為
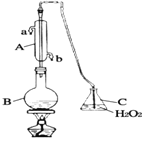
A. 0.256 g/L B. 0.04 g/L C. 0.24 g/L D. 0.0768 g/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮的氧化物是大氣污染物之一,用活性炭或一氧化碳還原氮氧化物,可防止空氣污染。回答下列問題:
已知:2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol
C(s)+O2(g)=CO2(g) △H=- 393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
(1)若某反應的平衡常數(shù)表達式為K=![]() ,請寫出此反應的熱化學方程式:_______;下列措施能夠增大此反應中NO的轉化率的是(填字母代號)_________。
,請寫出此反應的熱化學方程式:_______;下列措施能夠增大此反應中NO的轉化率的是(填字母代號)_________。
a.增大容器壓強 b.升高溫度 c.使用優(yōu)質催化劑 d.增大CO的濃度
(2)向容積為2L的密閉容器中加入活性炭(足量)和NO,發(fā)生反應C(s)+2NO(g)![]() N2(g)+CO2(g),NO和N2的物質的量變化如下表所示。
N2(g)+CO2(g),NO和N2的物質的量變化如下表所示。
物質的量/mol | T1/℃ | T2/℃ | |||||
0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min | |
NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
①0~5min內,以CO2表示的該反應速率v(CO2)=______,該條件下的平衡常數(shù)K=________。
②第15 min后,溫度調整到T2,數(shù)據(jù)變化如上表所示,則T1_______ T2(填“>”“<”或“=”)。
③若30min時,保持T2不變,向該容器中再加入該四種反應混合物各2 mol,則此時反應_______移動(填“正向”“逆向”或“不”);最終達平衡時NO的轉化率a=______________。
(3)在25 ℃下,向濃度均0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成_____沉淀(填化學式),當兩種沉淀共存時,溶液中c(Mg2+)/c(Cu2+)=__________(已知25 ℃時Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E、F、G六種短周期主族元素,原子序數(shù)依次增大。其中B的單質在常溫下為雙原子分子,它與A的單質可形成分子X,X的水溶液呈堿性;A、D同主族,D的焰色反應為黃色;E的簡單陽離子與X具有相同電子數(shù),且E是同周期中簡單離子半徑最小的元素;F元素的原子最外層比次外層少兩個電子,C、G兩種元素的原子最外層共有13個電子。則
(1)F在元素周期表中的位置為_______________。
(2)在2 L的密閉容器中,充入2 mol B2和3 mol A2,在一定條件下發(fā)生反應,5 s后測得A2為1.8 mol,則以B2的表示的反應速率v(B2)為__________________________。
(3)常溫下,液態(tài)的B2A4與氣態(tài)的BC2兩者發(fā)生反應生成無毒物質,16g B2A4發(fā)生反應放熱akJ,該反應的熱化學方程式為_______________。
(4)D2F溶液在空氣中長期放置發(fā)生反應,生成一種強堿與D2F2。D2F2與過氧化鈉的結構和化學性質相似,其溶液顯黃色。D2F2的電子式為_______,寫出D2F在空氣中長期放置生成D2F2的化學反應方程式為:_____________。D2F2的溶液與稀硫酸反應產生的現(xiàn)象為_____________。
(5)化學家發(fā)現(xiàn)一種化學式為A4B4的離子化合物,一定條件下1mol A4B4熔融電離生成兩種離子各1mol,則該物質熔融時的電離方程式為____________。
(6)向30mL某濃度由A、B、C、D中三種元素形成一元強堿溶液通入CO2氣體后得溶液M,因CO2通入量的不同,溶液M的組成也不同。若向M中逐滴加入0.1mol/L鹽酸,產生的氣體V(CO2)與加入鹽酸的體積V[HCl(aq)]的關系有下列圖示兩種情況(不計CO2的溶解)。

則曲線Y表明M中的溶質為________;原NaOH溶液的物質的量濃度為_______;由曲線X、Y可知,兩次實驗通入的CO2的體積比為_________。
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com