

 O2(g)═CO2(g)△H=-282kJ?mol-1 ②H2(g)+
O2(g)═CO2(g)△H=-282kJ?mol-1 ②H2(g)+ O2(g)═H2O(g)△H=-241.8kJ?mol-1
O2(g)═H2O(g)△H=-241.8kJ?mol-1

科目:高中化學 來源: 題型:閱讀理解

查看答案和解析>>
科目:高中化學 來源: 題型:
| c(H2O) |
| c(CO2)c2(NH3) |
| c(H2O) |
| c(CO2)c2(NH3) |
查看答案和解析>>
科目:高中化學 來源:2013-2014學年浙江省溫州市十校聯合體高三上學期期末考試理綜化學試卷(解析版) 題型:填空題
氨是最重要的化工產品之一。
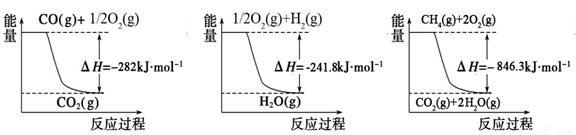
(1)合成氨用的氫氣可以甲烷為原料制得:CH4(g)+H2O(g) CO(g)+3H2(g)。有關化學反應的能量變化如下圖所示。CH4(g)與H2O(g)反應生成CO(g)和H2(g)的熱化學方程式為
。
CO(g)+3H2(g)。有關化學反應的能量變化如下圖所示。CH4(g)與H2O(g)反應生成CO(g)和H2(g)的熱化學方程式為
。



(2)CO對合成氨的催化劑有毒害作用,常用乙酸二氨合銅(Ⅰ)溶液來吸收原料氣中CO,其反應原理為:[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g) [Cu(NH3)3]CH3COO·CO(l) △H<0。吸收CO后的乙酸銅氨液經過適當處理后又可再生,恢復其吸收CO的能力以供循環使用,再生的適宜條件是 __________(填寫選項編號)。
[Cu(NH3)3]CH3COO·CO(l) △H<0。吸收CO后的乙酸銅氨液經過適當處理后又可再生,恢復其吸收CO的能力以供循環使用,再生的適宜條件是 __________(填寫選項編號)。
A.高溫、高壓 B.高溫、低壓 C.低溫、低壓 D.低溫、高壓
(3)用氨氣制取尿素[CO(NH2)2]的反應為:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g) △H<0。某溫度下,向容積為100L的密閉容器中通入4mol
NH3和2molCO2,該反應進行到40 s時達到平衡,此時CO2的轉化率為50%。該溫度下此反應平衡常數K的值為________。下圖中的曲線表示該反應在前25 s內的反應進程中的NH3濃度變化。若反應延續至70s,保持其它條件不變情況下,請在圖中用實線畫出使用催化劑時該反應的進程曲線。
CO(NH2)2(l)+H2O(g) △H<0。某溫度下,向容積為100L的密閉容器中通入4mol
NH3和2molCO2,該反應進行到40 s時達到平衡,此時CO2的轉化率為50%。該溫度下此反應平衡常數K的值為________。下圖中的曲線表示該反應在前25 s內的反應進程中的NH3濃度變化。若反應延續至70s,保持其它條件不變情況下,請在圖中用實線畫出使用催化劑時該反應的進程曲線。

(4)將尿素施入土壤后,大部分是通過轉化為碳酸銨或碳酸氫銨后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,轉化為碳酸銨。已知弱電解質在水中的電離平衡常數(25℃)如下表:
|
弱電解質 |
H2CO3 |
NH3·H2O |
|
電離平衡常數 |
Ka1=4.30×10-7 Ka2=5.61×10-11 |
1.77×10-5 |
現有常溫下0.1 mol·L-1的(NH4)2CO3溶液,
①你認為該溶液呈 性(填“酸”、“中”、“堿”),原因是 。
②就該溶液中粒子之間有下列關系式,你認為其中正確的是 。
A.c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3·H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+ c(HCO3-)+c(H2CO3)=0.1 mol·L-1
D.c(NH4+)+ c(NH3·H2O)=2c(CO32-)+ 2c(HCO3-)+2c(H2CO3)
查看答案和解析>>
科目:高中化學 來源:2012-2013學年廣東省廣州市高三調研測試理綜化學試卷(解析版) 題型:計算題
氨是最重要的化工產品之一。
(1)合成氨用的氫氣可以甲烷為原料制得。有關化學反應的能量變化如下圖所示。
反應①②③為_________反應(填“吸熱”或“放熱”)。CH4(g)與H2O(g)反應生成CO(g)和H2(g)的熱化學方程式為__________________。
① ② ③
(2)用氨氣制取尿素[CO(NH2)2]的反應為:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)。
CO(NH2)2(l)+H2O(g)。
①某溫度下,向容積為10L的密閉容器中通入2mol NH3和1molCO2,反應達到平衡時CO2的轉化率為50%。該反應的化學平衡常數表達式為K=___________。該溫度下平衡常數K的計算結果為____________。
②為進一步提高CO2的平衡轉化率,下列措施中能達到目的的是_____________
A.提高NH3的濃度 B.增大壓強
C.及時轉移生成的尿素 D.使用更高效的催化劑
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com