
| 溫度℃ | 400 | 500 | 830 | 1 000 |
| 平衡常數K | 10 | 9 | 1 | 0.6 |
| A | B | C | D | |
| n(CO2)/mol | 0 | 1 | 3 | 1 |
| n(H2)/mol | 0 | 2 | 2 | 1 |
| n(CO)/mol | 3 | 0.5 | 1 | 2 |
| n(H2O)/mol | 3 | 2 | 5 | 2 |
分析 (1)根據平衡常數隨溫度的變化表得出,溫度越低,平衡常數越大,據此分析;
(2)化學反應達到化學平衡狀態時,正逆反應速率相等,且不等于0,各物質的濃度不再發生變化,由此衍生的一些物理量不發生變化,以此進行判斷;
(3)根據830℃時,平衡常數k=1,依據濃度計算和平衡常數比較判斷;
(4)依據平衡三段式列式計算反應的一氧化碳,根據轉化率=$\frac{轉化量}{總量}$×100%,v=$\frac{△c}{△t}$計算得到.
解答 解:(1)由平衡常數隨溫度的變化表得出,溫度越低,平衡常數越大,則降低溫度,平衡正向移動,故答案為:正向移動;
(2)A、反應前后氣體的體積不變,故容器內混合氣體分子總數不再發生變化不能作為判斷是否達到化學平衡狀態的依據,故A錯誤;
B、密度=$\frac{總質量}{體積}$,總質量不變,體積不變,故混合氣體的密度不再改變不能作為判斷是否達到平衡狀態的依據,故B錯誤;
C、K=$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$僅與溫度有關,又恒容絕熱容器,所以$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$不再變化即溫度不變可作為判斷是否達到平衡狀態的依據,故C正確;
D、單位時間內消耗18g H2O即1mol同時生成1mol CO2,都是指正反應方向,不能作為判斷是否達到平衡狀態的依據,故D錯誤;
故選C;
(3)根據830℃時,平衡常數k=1計算;
A、只有反應物,反應向正反應方向移動,故A正確;
B、Q=$\frac{1×2}{0.5×2}$>1,反應向逆反應方向移動,故B錯誤;
C、Q=$\frac{2×3}{5×1}$>1,反應向逆反應方向移動,故C錯誤;
D、Q=$\frac{1×1}{2×2}$=$\frac{1}{4}$<1,反應向正反應方向移動,故D正確;
故答案為:AD;
(4)830℃時,在2L的密閉容器中加入4molCO(g)和4molH2O(g)達到平衡時,設一氧化碳轉化物質的量為x,依據平衡三段式列式得到
CO(g)+H2O(g)?H2(g)+CO2(g)
起始量(mol) 4 4 0 0
變化量(mol) x x x x
平衡量(mol) 4-x 4-x x x
平衡常數K=$\frac{x{\;}^{2}}{(4-x)(4-x)}$=1,解得x=2mol
CO的轉化率=$\frac{2mol}{4mol}$×100%=50%,v(CO)=$\frac{△c}{△t}$=$\frac{\frac{2mol}{2L}}{2min}$=0.5mol/(L•min);
故答案為:50%;0.5mol/(L•min).
點評 本題考查化學平衡狀態的判斷、移動原理及其平衡常數的分析判斷,題目難度不大,要注意把握平衡狀態的特征.


科目:高中化學 來源: 題型:選擇題
| A. | $\frac{z}{12m}$ | B. | $\frac{12z}{m}$ | C. | $\frac{{N}_{A}}{m}$ | D. | $\frac{{N}_{A}}{z}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 實驗編號 | NaOH溶液的濃度 (mol/L) | 滴定完成時,NaOH溶液滴入的體積(mL) | 待測鹽酸溶液的體積 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 堿式碳酸銅是一種化工原料,化學式用mCu(OH)2•nCuCO3表示.實驗室以廢銅屑為原料制取堿式碳酸銅的步驟如下:
堿式碳酸銅是一種化工原料,化學式用mCu(OH)2•nCuCO3表示.實驗室以廢銅屑為原料制取堿式碳酸銅的步驟如下:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
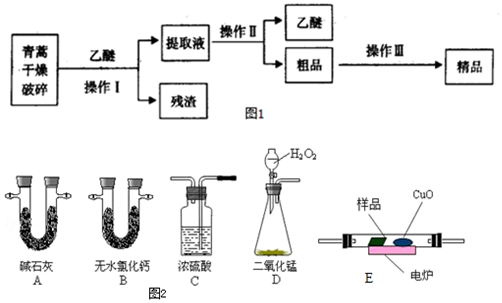
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
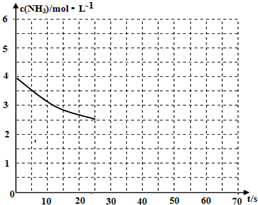 (2)①用氨氣制取尿素[CO(NH2)]的反應為:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H<0.
(2)①用氨氣制取尿素[CO(NH2)]的反應為:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H<0.查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | Ba2+、SO42-,Fe3+、K+ | B. | OH-、C1-、Na+ | ||
| C. | NH4+、NO3-、A13+、K+ | D. | HCO3-、SO42-、Na+、H+ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com