
分析 (1)A.氯水中含HClO,具有強氧化性,可漂白試紙;
B.向冰醋酸中加水,醋酸電離,氫離子濃度最大時導電性最強;
C.廢液時應回收處理;
D.化學藥品不能品嘗;
E.飽和NaCl溶液不能除去乙酸;
F.若用待測液潤洗錐形瓶,消耗的標準液偏多;
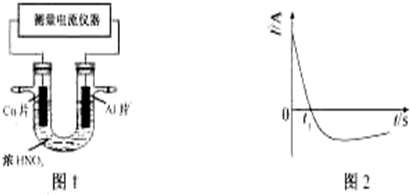
(2)Al、Cu片插入濃HNO3中組成原電池,0-t1時,Al在濃硝酸中發生鈍化過程,Al為負極,氧化得到氧化鋁,應有水參加,根據電荷守恒可知,有氫離子生成,Cu為正極,硝酸根放電生成二氧化氮,應由氫離子參與反應,同時有水生成,隨著反應進行鋁表面鈍化形成氧化膜阻礙反應進行,t1時,銅做負極反應,Al為正極.
解答 解:(1)A.氯水中含HClO,具有強氧化性,可漂白試紙,不能測定pH,應選pH計,故A錯誤;
B.向冰醋酸中加水,醋酸電離,氫離子濃度最大時導電性最強,則溶液導電性最強時pH最小,故B正確;
C.廢液時應回收處理,不能稀釋后沖入下水道,會污染地下水和土壤,故C錯誤;
D.化學藥品不能品嘗,可能發生中毒,故D錯誤;
E.飽和NaCl溶液不能除去乙酸,應選飽和碳酸鈉溶液,故E錯誤;
F.若用待測液潤洗錐形瓶,消耗的標準液偏多,則會導致實驗結果偏大,故F正確;
故答案為:BF;
(2)0-t1時,原電池的負極是Al片,此時,正極的電極反應式是2H++NO3-+e-=NO2↑+H2O,溶液中的H+向正極移動,t1時,原電池中電子流動方向發生改變,其原因是Al在濃硝酸中發生鈍化,氧化膜阻止了Al進一步反應,Cu為負極,
故答案為:2H++NO3-+e-=NO2↑+H2O;正;Al在濃硝酸中發生鈍化,氧化膜阻止了Al進一步反應,Cu為負極.
點評 本題考查化學實驗方案的評價及原電池,為高頻考點,把握物質的性質、發生的反應、中和滴定、原電池及實驗技能為解答的關鍵,側重分析與實驗能力的考查,注意實驗評價性分析,題目難度不大.


科目:高中化學 來源: 題型:解答題

| T/K | 2.98 | 398 | 498 |
| 平衡常數K | 2.44×10-6 | K1 | K2 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 氨水與氯化鋁溶液反應產生氫氧化鋁沉淀 | |
| B. | 用氨水做導電實驗,燈泡很暗 | |
| C. | 0.1mol/L的氨水的pH<13 | |
| D. | 氯化銨溶液的pH<7 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 硫酸溶液與氫氧化鋇溶液反應:Ba2++H++OH-+SO42-═BaSO4↓+H2O | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3NH3•H2O══Al(OH)3↓+3NH4+ | |
| C. | Na與水反應:Na+H2O═Na++OH-+H2↑ | |
| D. | 碳酸鈉與氫氧化鈉:HCO3-+OH-═CO32-+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 服用鉻含量超標的藥用膠囊會對人體健康造成危害 | |
| B. | “血液透析”利用了膠體的性質 | |
| C. | 明礬水解時產生具有吸附性的膠體粒子,可作漂白劑 | |
| D. | 新型復合材料使手機、電腦等電子產品更輕巧、實用和新潮 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1.0mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 酚酞呈紅色的溶液:NH4+、Ba2+、CO32-、Cl- | |
| C. | pH=12的溶液:K+、Na+、CH3COO-、Br- | |
| D. | 與鋁反應產生大量氫氣的溶液:Na+、K+、CO32-、NO3- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com