
(14分)氟和氟鹽是化工原料。由于氟氣性質活潑,很晚才制取出來。
(1)不能通過電解純凈的液態HF獲得F2,其原因是 ;但電解液態KHF2時,兩極分別得到F2和H2,寫出陽極上HF2- 放電產生氣體的電極反應式 。
(2)利用K2MnF6和SbF5在一定條件下發生反應也能制取氟,同時生成KSbF6和MnF3,化學方程式為 ,其中還原產物是 。
(3)已知氟化氫氣體中存在下列平衡:H3F3 3HF △H>0, H2F2
3HF △H>0, H2F2 2HF △H>0。
2HF △H>0。
①若在定溫定容條件下再充入H3F3,則H3F3與HF的濃度(mol/L)比值 (填“增大”“減小”或“不變”,下同);
②若在定溫定容條件下再充入HF,則H3F3與HF 的濃度(mol/L)比值 。
(4)一定濃度的HF和Al2(SO4)3混合液中,鋁的各種微粒含量?隨pH的分布曲線如圖示。用NaOH使混合液的pH從5調整到7,寫出有關反應的離子方程式為
。
_
(14分)
(4)AlF2++3OH-=Al(OH)3↓+2F-(2分),AlF3+3OH-=Al(OH)3↓+3F-(2分)
解析考點:制備實驗方案的設計;氧化還原反應方程式的配平;弱電解質在水溶液中的電離平衡;電解原理;鹵素原子結構及其性質的比較.
分析:(1))氟化氫是共價化合物,純液態不導電;陽極發生氧化反應,HF2-在陽極上放電,生成F2與H+;
(2)反應中Mn元素化合價由+4價降低為MnF3中+3價,總共降低1價,F元素化合價由-1價升高為F2中0價,總共升高2價,化合價升降最小公倍數為2,所以MnF3系數為2,F2系數為1,再根據元素守恒配平其它物質的系數;
氧化劑發生還原反應生成的物質是還原產物;
(3)HF的電離平衡常數Ka= 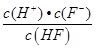 ,溶液pH=4,則溶液中c(H+)=10-4 mol?L-1,所以平衡時c(HF)=(0.10-1×10-4) mol?L-1≈0.10 mol?L-1,c(F-)=(0.10+1×10-4)mol?L-1≈0.10mol?L-1,代入電離平衡常數計算;
,溶液pH=4,則溶液中c(H+)=10-4 mol?L-1,所以平衡時c(HF)=(0.10-1×10-4) mol?L-1≈0.10 mol?L-1,c(F-)=(0.10+1×10-4)mol?L-1≈0.10mol?L-1,代入電離平衡常數計算;
(4)由圖可知溶液pH=5時,混合液中鋁的微粒為AlF2+、AlF3,pH值=7時,鋁的微粒為Al(OH)3,即AlF2+、AlF3與OH-反應生成Al(OH)3、F-.
解:(1))氟化氫是共價化合物,純液態時不電離,因而不導電,故不能通過電解純凈的液態HF獲得F2;
陽極發生氧化反應,HF2-在陽極上放電,生成F2與H+,電極反應式為HF2--2e-=F2↑+H+,
故答案為:氟化氫是共價化合物,純液態時不電離,因而不導電;HF2--2e-=F2↑+H+;
(2)反應中Mn元素化合價由+4價降低為MnF3中+3價,總共降低1價,F元素化合價由-1價升高為F2中0價,總共升高2價,化合價升降最小公倍數為2,所以MnF3系數為2,F2系數為1,根據錳元素守恒可知K2MnF6系數為2,根據K元素守恒可知KSbF6系數為4,根據Sb元素守恒可知SbF5系數為4,反應方程式為2K2MnF6+4SbF5=4KSbF6+2MnF3+1F2↑;
反應中Mn元素化合價由K2MnF6中+4價降低為MnF3中+3價,K2MnF6發生還原反應生成MnF3,MnF3是還原產物.
故答案為:2;4;4;2;1;MnF3;
(3)解:溶液pH=4,則溶液中c(H+)=10-4 mol?L-1,
HF  H++F-
H++F-
開始( mol?L-1):0.10 0 0.10
平衡( mol?L-1):(0.10-1×10-4) 1×10-4(0.10+1×10-4)
c(HF)=(0.10-1×10-4) mol?L-1≈0.10 mol?L-1
c(F-)=(0.10+1×10-4)mol?L-1≈0.10mol?L-1
Ka=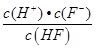 =
=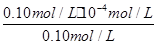 =1.0×10-4 mol?L-1,
=1.0×10-4 mol?L-1,
答:該溫度下HF的電離平衡常數近似為1.0×10-4 mol?L-1;
(4)由圖可知溶液pH=5時,混合液中鋁的微粒為AlF2+、AlF3,pH值=7時,鋁的微粒為Al(OH)3,即AlF2+、AlF3與OH-反應生成Al(OH)3、F-,反應離子方程式為AlF2++3OH-=Al(OH)3↓+2F-、AlF3+3OH-=Al(OH)3↓+3F-,
故答案為:AlF2++3OH-=Al(OH)3↓+2F-、AlF3+3OH-=Al(OH)3↓+3F-.


科目:高中化學 來源: 題型:
(14分)氟和氟鹽是化工原料。由于氟氣性質活潑,很晚才制取出來。
(1)不能通過電解純凈的液態HF獲得F2,其原因是 ;但電解液態KHF2時,兩極分別得到F2和H2,寫出陽極上HF2- 放電產生氣體的電極反應式 。
(2)利用K2MnF6和SbF5在一定條件下發生反應也能制取氟,同時生成KSbF6 和MnF3,化學方程式為 ,其中還原產物是 。
(3)已知氟化氫氣體中存在下列平衡 :H3F3 3HF △H >0, H2F2
2HF △H >0。
①若在定溫定容條件下再充入H3F3,則H3F3與HF的濃度(mol/L)比值 (填“增大”“減小”或“不變”,下同);
②若在定溫定容條件下再充入HF,則H3F3與HF 的濃度(mol/L)比值 。
(4)一定濃度的HF和Al2(SO4)3混合液中,鋁的 各種微粒含量ƒ隨pH的分布曲線如圖示。用NaOH使混合液的pH從5調整到7,寫出有關反應的離子方程式為
。
查看答案和解析>>
科目:高中化學 來源:2011-2012學年江蘇省高三上學期期中考試化學試卷 題型:填空題
(14分)氟和氟鹽是化工原料。由于氟氣性質活潑,很晚才制取出來。
(1)不能通過電解純凈的液態HF獲得F2,其原因是 ;但電解液態KHF2時,兩極分別得到F2和H2,寫出陽極上HF2- 放電產生氣體的電極反應式 。
(2)利用K2MnF6和SbF5在一定條件下發生反應也能制取氟,同時生成KSbF6 和MnF3,化學方程式為 ,其中還原產物是 。
(3)已知氟化氫氣體中存在下列平衡 :H3F3 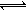 3HF △H >0, H2F2
3HF △H >0, H2F2 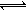 2HF △H >0。
2HF △H >0。
①若在定溫定容條件下再充入H3F3,則H3F3與HF的濃度(mol/L)比值 (填“增大”“減小”或“不變”,下同);
②若在定溫定容條件下再充入HF,則H3F3與HF 的濃度(mol/L)比值 。
(4)一定濃度的HF和Al2(SO4)3混合液中,鋁的 各種微粒含量ƒ隨pH的分布曲線如圖示。用NaOH使混合液的pH從5調整到7,寫出有關反應的離子方程式為
。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com