
 實驗室模擬用鉻鐵礦(主要成分是FeO•Cr2O3)制備紅礬鈉(Na2Cr2O7•2H20).
實驗室模擬用鉻鐵礦(主要成分是FeO•Cr2O3)制備紅礬鈉(Na2Cr2O7•2H20).分析 (1)依據化學方程式4FeO•Cr2O3+8Na2CO3+7O2=2Fe2O3+8Na2CrO4+8CO2,分析反應過程中元素化合價變化,計算電子轉移總數得到
(2)Na2CrO4中加入硫酸酸化,得到Na2Cr2O7和Na2SO4混合溶液,根據電荷守恒和元素守恒可書寫離子方程式;酸性條件下Cr2O72-能將Cl-氧化成氯氣;
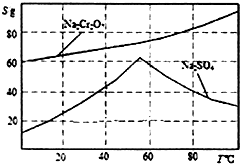
(3)由圖可知,溫度高有利于硫酸鈉結晶析出,所以要分離出Na2SO4,則必須的實驗操作是蒸發濃縮、趁熱過濾;濾液的溫度較高,從溶液中獲得晶體需要冷卻結晶;
(4)①用Na2S2O3標準溶液滴定碘溶液,由于Na2S2O3溶液顯堿性,所以要將置于堿式滴定管中,滴定終點時,溶液的藍色褪去,據此判斷;
②根據電子得失守恒有關系式Na2Cr2O7~3I2~6Na2S2O3,根據關系式結合Na2S2O3的物質的量可計算出Na2Cr2O7的質量,進而確定產品中的Na2Cr2O7的質量分數.
解答 解:(1)4FeO•Cr2O3+8Na2CO3+7O2=2Fe2O3+8Na2CrO4+8CO2,反應中依據元素化合價變化可知,氧氣是氧化劑,7mol氧氣反應得到電子28mol,所以生成8molNa2CrO4轉移的電子數28mol,生成1mol Na2CrO4轉移的電子數為3.5mol,
故答案為:O2;3.5;
(2)Na2CrO4中加入硫酸酸化,得到Na2Cr2O7和Na2SO4混合溶液,反應的離子方程式為2CrO42-+2H+=Cr2O72-+H2O,酸性條件下Cr2O72-能將Cl-氧化成氯氣,而損失目標產物,所以不能用鹽酸酸化,
故答案為:2CrO42-+2H+=Cr2O72-+H2O;酸性條件下Cr2O72-能將Cl-氧化而損失目標產物;
(3)由圖可知,溫度高有利于硫酸鈉結晶析出,所以要分離出Na2SO4,則必須的實驗操作是蒸發濃縮、趁熱過濾;濾液的溫度較高,從溶液中獲得晶體需要冷卻結晶,
故答案為:趁熱過濾;冷卻結晶;
(4)①用Na2S2O3標準溶液滴定碘溶液,由于Na2S2O3溶液顯堿性,所以要將置于堿式滴定管中,判斷達到滴定終點的依據是當滴加最后一滴Na2S2O3溶液時,溶液藍色褪去,半分鐘內不變色,
故答案為:堿式滴定管;當滴加最后一滴Na2S2O3溶液時,溶液藍色褪去,半分鐘內不變色;
②根據電子得失守恒有關系式Na2Cr2O7~3I2~6Na2S2O3,測定中消耗的Na2S2O3的物質的量為0.04L×0.1200mol•L-1=0.0048mol,所以Na2Cr2O7的質量為0.0048mol×$\frac{1}{6}$×262g/mol=0.2096g,所以產品中的Na2Cr2O7的質量分數為$\frac{0.2096g}{0.2500g}$×100%=83.84%,
故答案為:83.84%.
點評 本題考查了物質制備的流程分析判斷,物質性質和實驗操作的分析應用,把握晶體析出的原理和溶解度變化特征的分析是解題關鍵,題目難度中等,側重于考查學生的實驗能力、分析問題、解決問題的能力.


 口算能手系列答案
口算能手系列答案科目:高中化學 來源: 題型:解答題
 如圖所示裝置中,甲、乙兩個燒杯分別盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液,電極均為石墨電極.
如圖所示裝置中,甲、乙兩個燒杯分別盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液,電極均為石墨電極.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
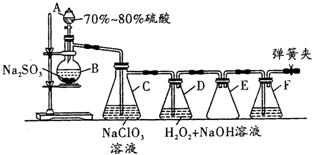 用二氧化氯(ClO2)可制備用途廣泛的亞氯酸鈉(NaClO2),實驗室可用如圖所示裝置(部分支持裝置省略)制備少量的亞氯酸鈉.
用二氧化氯(ClO2)可制備用途廣泛的亞氯酸鈉(NaClO2),實驗室可用如圖所示裝置(部分支持裝置省略)制備少量的亞氯酸鈉.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 質子數為16、中子數為17的硫原子:$\stackrel{17}{16}S$ | |
| B. | 硫離子(S2-)的結構示意圖: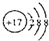 | |
| C. | 二硫化碳分子的結構式:S=C=S | |
| D. | 硫化氫分子的電子式: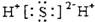 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 蓄電池放電時,每消耗0.1molPbO2,則共生成0.1molPbSO4 | |
| B. | 電解硫酸鈉溶液時的陽極反應式為4OH--4e=2H2O+O2↑ | |
| C. | 電解一段時間后若硫酸鈉溶液中沒有晶體析出則c(Na2SO4)不變 | |
| D. | 蓄電池放電一段時間后其電解液中H2SO4的濃度、密度都變大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
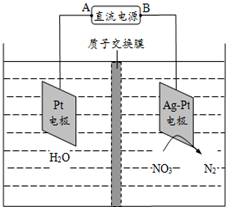
| A. | 鉛蓄電池的A極為正極,電極材料為PbO2 | |
| B. | 該電解池的陰極反應式為:2NO3-+12H++10e-═N2↑+6H2O | |
| C. | 該電解池的總反應方程式為:2H2O+4NO3-$\frac{\underline{\;電解\;}}{\;}$2N2↑+5O2↑+4OH- | |
| D. | 若電解過程中轉移2mol電子,則交換膜右側電解液的質量減少5.6g |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com