
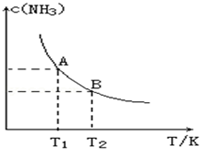
 在一定條件下,將1.00molN2(g)與3.00molH2(g)混合于一個10.0L密閉容器中,在不同溫度下達到平衡時NH3(g)的平衡濃度如圖所示.其中溫度為T1時平衡混合氣體中氨氣的體積分數為25.0%.
在一定條件下,將1.00molN2(g)與3.00molH2(g)混合于一個10.0L密閉容器中,在不同溫度下達到平衡時NH3(g)的平衡濃度如圖所示.其中溫度為T1時平衡混合氣體中氨氣的體積分數為25.0%.分析 ①由圖1可知,溫度越高,平衡時NH3的濃度越小,說明升高溫度平衡向逆反應進行,平衡常數減小;
②令參加反應的氮氣的物質的量為nmol,利用三段式用n表示處于平衡時各組分的物質的量,根據氨氣的體積分數列方程計算n的值,再N2的化學反應速率;
③T1溫度下該反應的化學平衡常數K1;
解答 解:①由圖可知,溫度越高,平衡時NH3的濃度越小,說明升高溫度平衡向逆反應進行,平衡常數減小,故平衡常數KA>KB,溫度越高,K值越小,所以正反應是放熱反應,
故答案為:>;<;
②令參加反應的氮氣的物質的量為nmol,則:
N2(g)+3H2(g)?2NH3(g)
開始(mol):1 3 0
變化(mol):n 3n 2n
平衡(mol):1-n 3-3n 2n
所以所以$\frac{2n}{(1-n)mol+(3-3n)mol+2nmol}$×100%=25%,解得n=0.4,這段時間內N2的化學反應速率為$\frac{\frac{0.4mol}{10L}}{5.00min}$=8.00×10-3mol/(L•min),
故答案為:8.00×10-3mol/(L•min);
③K1=$\frac{(\frac{2×0.4mol}{10L})^{2}}{\frac{(1-0.4)mol}{10L}×(\frac{3mol-3×0.4mol}{10L})^{3}}$=18.3L2/mol2
故答案為:18.3L2/mol2;
點評 本題考查化學平衡計算、反應速率計算、平衡常數計算及應用,難度中等,注意理解掌握平衡常數的應用.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | SO2中有少量HCl氣體(氫氧化鈉溶液) | B. | CO中混有CO2(石灰水、濃硫酸) | ||
| C. | CO2中有少量CO(灼熱氧化銅) | D. | Cl2中混有HCl(飽和食鹽水、濃硫酸) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 一定量的CO2與足量的C在恒容密閉容器中發生反應:C(s)+CO2(g)?2CO(g)△H.
一定量的CO2與足量的C在恒容密閉容器中發生反應:C(s)+CO2(g)?2CO(g)△H.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H+(aq)+OH-(aq)=H2O(l)△H=-a kJ/mol,故1 mol NaOH固體與足量的稀鹽酸反應,放出熱量為a kJ | |
| B. | 因CuSO4•5H2O(s)=CuSO4(s)+5H2O(1)△H=+b kJ/mol,故1 mol CuSO4( s)溶于足量水時,放出熱量為b kJ | |
| C. | 因氫氣的燃燒熱為c kJ/mol,故電解水的熱化學方程式為:2H2O(1)=2H2( g)+O2( g)△H=+c kJ/mol | |
| D. | 因N2( g)+3H2( g)?2NH3( g)△H=-d kJ/mol,故在某容器中投入1 mol N2與3 mol H2 充分反應后,放出熱量小于d kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 甲醇和CO2可直接合成DMC:2CH3OH(g)+CO2 (g)?CH3OCOOCH3 (g)+H2O(g),但甲醇轉化率通常不會超過1%,制約該反應走向工業化生產.
甲醇和CO2可直接合成DMC:2CH3OH(g)+CO2 (g)?CH3OCOOCH3 (g)+H2O(g),但甲醇轉化率通常不會超過1%,制約該反應走向工業化生產.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 達到化學平衡時,將完全轉化為NH3 | |
| B. | 達到化學平衡時,N2、H2和NH3的物質的量濃度一定相等 | |
| C. | 達到化學平衡時,N2、H2和NH3的物質的量濃度不再變化 | |
| D. | 達到化學平衡時,正反應速率和逆反應速率都為零 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
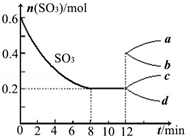 在一個2L的密閉容器中投入反應物,發生反應2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的變化如圖所示:
在一個2L的密閉容器中投入反應物,發生反應2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的變化如圖所示:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HCI+NaOH═NaCl+H2O | |
| B. | Zn+2HCl═ZnCl2+H2↑ | |
| C. | HCl+AgNO3═AgCl↓+HNO3 | |
| D. | MnO2+4HCI (濃) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+C12↑+2H2O |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com