
【題目】硼氫化鈉(NaBH4)是應用廣泛、性能較好的還原劑,以硼酸、甲醇和氫化鈉(NaH)為原料可制得硼氫化鈉。某學習小組的同學欲利用下圖所示路線在實驗室合成硼氫化鈉。

I.氫化鈉的制備
已知NaH的化學反應活性很高,在潮濕的空氣中能自燃,與酸接觸即放出熱量和氫引發燃燒甚至爆炸。該小組的同學利用下圖中的裝置在實驗室制取NaH。

(1)NaH中氫元素的化合價為___________,NaH的電子式為___________。
(2)按氣流方向連接各儀器接口,順序為a→___________b→c(填接口字母);連接裝置后進行實驗,在給裝置B加熱前,必須進行的一步操作是___________。
(3)裝置A中盛裝稀鹽酸的儀器名稱為___________,裝置D中應盛裝的試劑是___________。
(4)經分析,該實驗裝置有一個明顯的不足是____________,解決此不足的措施是__________。
Ⅱ.硼氫化鈉的制備與純度測定
在攪拌加熱到220℃時,向盛裝NaH的縮合反應罐中加入硼酸三甲酯[B(OCH3)3],升溫到260℃,充分反應后,經過處理得到NaBH4和甲醇鈉。
(5)某同學欲通過測定硼氫化鈉與水反應生成氫氣的體積來測定硼氫化鈉產品的純度。
已知:NaH+H2O=H2↑+NaOH。
①硼氫化鈉與水反應可以產生大量氫氣和偏硼酸鈉,該反應方程式為___________。
②該同學用圖裝置測定硼氫化鈉產品的純度(雜質只有氫化鈉)。裝置中a的作用是_________;稱取6.28g氫化鈉樣品,重復實驗操作三次,測得生成氣體的平均體積為13.44L(已折算為標準狀況),則樣品中硼氫化鈉的純度為___________%(結果保留兩位有效數字)。

【答案】-1 ![]() g→f→d→e 檢驗H2的純度 分液漏斗 堿液 未防止空氣中的水蒸氣進入裝置B中 在裝置B之后連接一個干燥裝置 NaBH4+2H2O=NaBO2+4H2↑ 平衡氣壓,便于液體順利滴下 85
g→f→d→e 檢驗H2的純度 分液漏斗 堿液 未防止空氣中的水蒸氣進入裝置B中 在裝置B之后連接一個干燥裝置 NaBH4+2H2O=NaBO2+4H2↑ 平衡氣壓,便于液體順利滴下 85
【解析】
(1)根據Na的化合價為+1價,化合物中所有元素正負化合價代數和等于0分析;二者形成離子化合物,每種微粒達到穩定結構;
(2)在A裝置中制取H2,通過D裝置除去H2中的HCl雜質,再通過C裝置干燥,最后通過B裝置制取NaH;除雜、干燥的裝置的導氣管都是長進短出;由于H2是可燃性氣體,在加熱制取NaH前,首先要檢驗H2純度,然后再加熱;
(3)根據裝置圖中A的結構判斷盛裝稀鹽酸的儀器名稱為;裝置D的作用是除去氫氣中的HCl雜質,可根據HCl的性質,確定其中應盛裝的試劑;
(4)根據NaH在潮濕的空氣中能自燃,結合裝置圖中各個裝置的作用可知缺少一個干燥裝置;缺少什么就及時補救什么裝置;
(5)①根據已知物質和待求物質結合質量守恒定律書寫方程式;
②導管a起連通器的作用,根據其連接的位置、結合其作用分析;
稱取6.28g氫化鈉樣品,發生的反應可能有NaBH4+2H2O=NaBO2+4H2↑、Na+H2O=NaOH+H2↑,由放出氫氣的體積計算氫氣的物質的量,根據固體的質量、H2的物質的量,可計算出硼氫化鈉的質量,最后可得其純度。
(1)在NaH中Na的化合價為+1價,由于在化合物中所有元素正負化合價代數和等于0,所有H為-1價;NaH為離子化合物,Na失去最外層電子形成Na+,H原子獲得1個電子形成H-,二者通過離子鍵結合,電子式為![]() ;
;
(2)在A裝置中用稀鹽酸與Zn反應制取H2,由于鹽酸具有揮發性,制取的H2中含有HCl、H2O,然后通過D裝置除去HCl氣體,再通過C裝置的濃硫酸對H2進行干燥,導氣管都是長進短出,這時就得到干燥、純凈的H2,將其通過B裝置,驅趕裝置內的空氣,待排出的氣體為純凈的氫氣時,給裝置B加熱,發生反應:2Na+H2![]() 2NaH;所以按氣流方向連接各儀器接口,順序為a→g→f→d→e→b→c;在給裝置B加熱前,必須進行的一步操作是檢驗從c排出的H2的純度;
2NaH;所以按氣流方向連接各儀器接口,順序為a→g→f→d→e→b→c;在給裝置B加熱前,必須進行的一步操作是檢驗從c排出的H2的純度;
(3)根據裝置圖可在儀器A是分液漏斗;裝置D目的是除去H2中的HCl雜質,可根據HCl的水溶液顯酸性,用堿性物質的水溶液如NaOH溶液來吸收除去HCl雜質;
(4) NaH在潮濕的空氣中能自燃,根據(2)的分析中制取裝置各個部分的作用,可知還缺少一個防止空氣中的水蒸氣進入裝置B的裝置;解決此不足的措施是在裝置B之后連接一個干燥裝置;
(5)①由于硼氫化鈉與水反應可以產生大量氫氣和偏硼酸鈉,則該反應方程式為NaBH4+2H2O=NaBO2+4H2↑;
②導管a起連通器的作用,使液面上下氣體壓強一致,這樣漏斗中的液體在重力作用下可以順利滴下。因此裝置中a的作用是平衡氣壓,便于液體順利滴下;
6.28g氫化鈉樣品,發生反應:NaBH4+2H2O=NaBO2+4H2↑、NaH+H2O=NaOH+H2↑,放出氫氣的物質的量為n(H2)= 13.44L÷22.4L/mol=0.6mol,假設NaBH4是物質的量為x,NaH的物質的量為y,則38x+24y=6.28g;4x+y=0.6,解得x=0.14mol,y=0.04mol,則樣品中硼氫化鈉的純度為![]() =85%。
=85%。


 華東師大版一課一練系列答案
華東師大版一課一練系列答案科目:高中化學 來源: 題型:
【題目】某結晶水合物分子式為RnH2O,其相對分子質量為M,25℃時,a g晶體溶于b g水中即飽和,形成V ml密度為ρ g/cm3的溶液,下列不正確的是 ( )
A. 飽和溶液的質量分數為![]() B. 25℃,R的溶解度為
B. 25℃,R的溶解度為![]() g
g
C. 飽和溶液的質量分數為![]() D. 飽和溶液物質的量濃度為
D. 飽和溶液物質的量濃度為![]() mol/L
mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是元素周期表的一部分,請回答有關問題:

(1)表中化學性質最不活潑的元素,其原子結構示意圖為______。
(2)元素⑦與⑧的原子半徑大小關系是:⑦______⑧(填“>”或“<”)。
(3)④⑤兩元素相比較,金屬性較強的是______ (填元素名稱)。
(4)元素①的最高價氧化物的水化物的化學式為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法與鹽類水解有關且正確的是: ( )
A. AlCl3溶液和NaAlO2溶液加熱、蒸發、濃縮、結晶、灼燒,所得固體的成分相同
B. 配制FeCl3溶液時,將FeCl3固體溶解在硫酸中,然后再用水稀釋到所需的濃度
C. 用加熱的方法可除去KCl溶液中混有的Fe3+
D. 食醋可以溶解水垢
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高分子化合物G是可被細菌作為碳源和能源利用的聚合物,屬于一種生物可降解高分子材料,在食品、藥品包裝方面具有獨特優勢。已知A~G均為有機化合物,以下為高分子化合物G的一種合成路線:
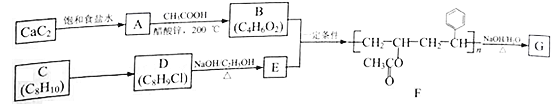
回答以下問題:
(1)由CaC2制備A的化學方程式為_________________________________。
(2)A生成B的反應類型為______________________。
(3)C的化學名稱是___________,C→D所需試劑和條件分別是___________、___________。
(4)E的結構簡式為______________________。
(5)芳香族化合物H是D的同分異構體,則H可能的結構共有___________種(不包括D),寫出核磁共振氫譜有三組峰且峰面積之比為1︰2︰6的H的同分異構體的結構簡式___________(任寫一種)。
(6)由F生成G的化學方程式為_________________________________。
(7)參考題中信息,設計由1,2二氯乙烷和冰醋酸為原料制取![]() 的合成線路圖(無機試劑任選)__________________。
的合成線路圖(無機試劑任選)__________________。
已知:-OH與碳碳雙鍵兩端的碳原子直接相連不穩定,會自變成—CHO。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在373K時,把0.5mol N2O4氣體通入體積為5L的恒容密閉容器中,立即出現紅棕色。反應進行到2秒時,NO2的濃度為0.02 mol/L。在60秒時,體系已達平衡,此時容器內壓強為開始時的1.6倍。下列說法正確的是( )
A. 前2秒,以N2O4的濃度變化表示的平均反應速率為0.01mol/(L·s)
B. 在2秒時體系內的壓強為開始時的1.2倍
C. 在平衡時體系內含N2O40.20mol
D. 平衡時,如果再充入一定量N2O4, 則可提高N2O4的轉化率
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以高氯冶煉煙灰(主要成分為銅鋅的氯化物、氧化物、硫酸鹽,少量鐵元素和砷元素)為原料,可回收制備Cu和ZnSO4·H2O,其主要實驗流程如下:

已知:①Fe3+完全沉淀pH為3.2,此時Zn2+、Cu2+未開始沉淀;②K3[Fe(CN)6]可用于檢驗Fe2+:3Fe2++2[Fe(CN)6]3-===Fe3[Fe(CN)6]2↓(深藍色);③砷元素進入水體中對環境污染大,可通過沉淀法除去。
(1)兩段脫氯均需在85 ℃條件下進行,適宜的加熱方式為________。
(2)堿洗脫氯時,溶液中Cu2+主要轉化為Cu(OH)2和Cu2(OH)2CO3,也會發生副反應得到Cu2(OH)3Cl沉淀并放出氣體,該副反應的離子方程式為________________________。若用NaOH溶液進行堿洗操作時,濃度不宜過大,通過下表的數據分析其原因是___________。
NaOH溶液濃度對脫氯率和其他元素浸出率的影響

(3)ZnSO4的溶解度曲線如下圖所示。“電解”后,從溶液中回收ZnSO4·H2O的實驗、操作為___________。

(4)濾液1和濾液2中含一定量的Cu2+、Zn2+。為提高原料利用率,可采取的措施有:將濾液1和濾液2混合,回收銅鋅沉淀物;循環使用電解過程產生的________(填化學式)。
(5)已知H3AsO3的還原性強于Fe2+,Ksp(FeAsO3)>Ksp(FeAsO4)=5.7×10-21。測得酸浸液中雜質鐵元素(以Fe2+存在)、砷元素(以H3AsO3存在)的濃度分別為1.15 g·L-1、0.58 g·L-1,可采用“氧化中和共沉淀”法除去,請設計實驗方案: ____________________________(實驗中須使用的試劑有:30%雙氧水,0.001 mol·L-1K3[Fe(CN)6]溶液,回收的銅鋅沉淀物)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“8.12”天津港爆炸中有一定量的氰化物泄露.氰化物多數易溶于水,有劇毒,易造成水污染.為了增加對氰化物的了解,同學們查找資料進行學習和探究。
探究氰化物的性質:已知部分弱酸的電離平衡常數如下表:
弱酸 | HCOOH | HCN | H2CO3 |
25℃電離平衡常數 | Ki=1.77×10﹣4 | Ki=5.0×10﹣10 | Ki1=4.3×10﹣7 Ki2=5.6×10﹣11 |
(1)NaCN溶液呈堿性的原因是________________________ (用離子方程式表示)
(2)如圖表示常溫下,稀釋HCOOH、HCN兩種酸的稀溶液時,溶液pH隨加水量的變化.下列說法正確的是_________

A.相同濃度的HCOONa和NaCN的混合溶液中,各離子濃度的大小關系是:c(Na+)>c(CN﹣)>c(HCOO﹣)>c(OH﹣)>c(H+)
B.向NaCN溶液中通入少量二氧化碳的離子方程式為:CN﹣+CO2+H2O=HCN+CO32﹣
C.圖像中a點酸的總濃度小于b點酸的總濃度
D.c點溶液的導電性比a點溶液的導電性弱
(3)H2O2有“綠色氧化劑”的美稱;也可消除水中的氰化物(如KCN),經以下反應實現:KCN+H2O2+H2O═A+NH3↑,則生成物A的化學式為_____。
(4)下列四種離子結合H+能力由弱到強的是______________________________________。
A. HCOO- B. CN- C. CO32- D.HCO3-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列溶液中有關物質的量濃度關系正確的是( )
A. 0.1 mol/L的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
B. NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)
C. 室溫下,由pH=1的CH3COOH溶液與pH=13的NaOH溶液等體積混合,溶液中離子濃度大小的順序為:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D. 常溫下,在pH=8的NaA溶液中:c(Na+)-c(A-)=9.9×10-7 mol/L
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com