
分析 同一核外沒有兩個電子的各個參數完全相同,原子核外每個電子的運動狀態都是不同的,Y的基態原子核外電子有5種不同的運動狀態,Y為B,X、Y分別代表原子序數依次增大的短周期主族元素,X元素原子的質子數等于其電子層數,X為H,同周期隨原子序數增大原子半徑減小,電子層越多原子半徑越大,R元素的原子半徑在短周期主族元素中最大,為鈉元素,X、Y、Z、R、T、U分別代表原子序數依次增大的短周期主族元素,Z與T同主族且原子序數T是Z的兩倍,Z為氧元素,T為硫元素,則U為氯元素.
(1)Z為氧元素,原子核外有8個電子,根據價層電子對互斥理論分析,價層電子對=σ 鍵電子對+中心原子上的孤電子對;
(2)非金屬性越強,最高價氧化物對應的水化物的酸性越強;
(3)根據晶體的構成微粒確定晶體類型;利用均攤法計算出氯化鈉晶胞中含有鈉離子和氯離子個數,再根據密度公式計算;
(4)Y的電負性為2.0,X的電負性為2.1,氫的非金屬性強于硼,B2H6氣體通人H20中反應生成一種酸為硼酸和一種單質為氫氣,據此書寫方程式.
解答 解:(1)Z與T同主族且原子序數T是Z的兩倍,Z為氧元素,T為硫元素,氧元素原子核外有8個電子,所以核外電子排布式為:1s22s22p4或[He]2s22p4,S原子形成3個σ鍵,孤對電子數=$\frac{6+2-3×2}{2}$=1,為sp3雜化,立體構型為三角錐型,
故答案為:1s22s22p4或[He]2s22p4;三角錐形;
(2)T為硫元素,則U為氯元素,同一周期,從左向右,非金屬性增強,非金屬性:Cl>S,非金屬性越強,最高價氧化物對應的水化物的酸性越強,故酸性:HClO4>H2SO4,
故答案為:HClO4>H2SO4;
(3)R元素的原子半徑在短周期主族元素中最大,為鈉元素,T為硫元素,則U為氯元素,化合物RU為氯化鈉,為金屬、非金屬元素組成的化合物,為離子化合物,
氯化鈉晶胞中鈉離子個數=1+12×$\frac{1}{4}$=4,氯離子個數=8×$\frac{1}{8}$,所以氯化鈉的密度ρ=$\frac{4M}{6.02×1{0}^{23}×V}$,
故答案為:離子晶體;$\frac{4M}{6.02×1{0}^{23}×V}$g/cm3;
(4)Y的電負性為2.0,X的電負性為2.1,氫的非金屬性強于硼,B2H6中H為-1價,B2H6氣體通人H20中反應生成硼酸和氫氣,反應方程式為:B2H6+6H2O═2H3BO3↓+6H2↑,
故答案為:B2H6+6H2O═2H3BO3↓+6H2↑.
點評 本題考查原子結構與元素的性質,為高頻考點,側重于學生的分析能力的考查,元素的推斷是解答的關鍵,注意把握元素的性質及單質、化合物的性質,突破口為Y的基態原子核外電子有5種不同的運動狀態,Y為B,題目難度中等,難點是晶胞計算中氯化鈉密度的計算.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
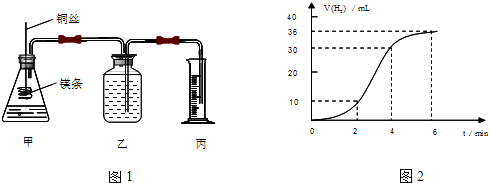
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | Mg、Al | B. | Mg、Fe | C. | Zn、Fe | D. | Al、Zn |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:填空題

| 滴定次數 | 1 | 2 | 3 | 4 |
| KMnO4溶液體積/mL | 20.60 | 20.02 | 20.00 | 19.98 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 編號 | 物質 | 試劑或操作名稱 |
| ① | 除雜質:NaHCO3溶液(Na2CO3) | |
| ② | 除雜質:MgO(Al2O3) | |
| ③ | 除雜質:FeCl2溶液(FeCl3) | |
| ④ | 鑒別:NaCl、KCl | |
| ⑤ | 鑒別:AlCl3、Al2(SO4)3溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
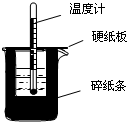 50mL0.50mol/L鹽酸與50mL0.55mol/LNaOH溶液在如圖所示的裝置中進行中和反應.通過測定反應過程中所放出的熱量可計算中和熱.回答下列問題:
50mL0.50mol/L鹽酸與50mL0.55mol/LNaOH溶液在如圖所示的裝置中進行中和反應.通過測定反應過程中所放出的熱量可計算中和熱.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 凡是中心原子采取sp3雜化的分子,其立體構型都是正四面體型 | |
| B. | 在SCl2中,中心原子S采取sp雜化軌道成鍵 | |
| C. | 雜化軌道只用于形成σ鍵或用于容納未參與成鍵的孤電子對 | |
| D. | 凡AB3型的共價化合物,其中心原子A均采用sp3雜化軌道成鍵 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com