
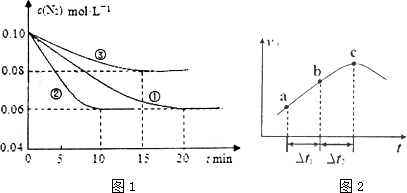
分析 (1)根據v=$\frac{△c}{△t}$計算反應速率,根據圖象可知②到達平衡的時間比①短,到達平衡時N2的濃度與①相同,化學平衡不移動,故②與①相比加了催化劑,①和③比較可知,③的速率比①小,平衡時氮氣的濃度高,即平衡逆向移動,故③減小了壓強;
(2)①根據反應方程式,利用平衡常數的定義計算;
②根據溫度對平衡常數的影響判斷;
③向絕熱密閉容器中通入一定量的NO2,根據圖象可知,反應開始反應物濃度最大,但反應速率逐漸增大,據此判斷;
(3)當a=b時,amol•L-1的氨水與b mol•L-1鹽酸等體積混合,反應后溶液呈酸性,若溶液顯中性,則酸的量要減少,故a>b,根據氨水的電離平衡常數的定義可計算電離平衡常數.
解答 解:(1)根據像可知,②在10min時達到平衡,此時氮氣的濃度變化為0.04mol/L,根據方程式或知,氨氣的濃度變化了0.08mol/L,根據v=$\frac{△c}{△t}$可知v(NH3)=$\frac{0.08mol/L}{10min}$=0.008mol•L-1•min-1,根據圖象可知②到達平衡的時間比①短,到達平衡時N2的濃度與①相同,化學平衡不移動,故②與①相比加了催化劑,故選e,①和③比較可知,③的速率比①小,平衡時氮氣的濃度高,即平衡逆向移動,故③升減小了壓強,故選b,
故答案為:0.008mol•L-1•min-1;e;b;
(2)①2 NO2(g)?N2O4(g)
起始時 0.2mol•L-1 0
轉化 0.1mol•L-1 0.05mol•L-1
平衡時 0.1mol•L-1 0.05mol•L-1
故平衡常數K=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$=$\frac{0.05}{0.{1}^{2}}$L•mol-1=5L•mol-1,
故答案為:5L•mol-1;
②溫度升高,此平衡向逆反應方向移動,K值減小,
故答案為:減小;
③反應開始反應物濃度最大,但反應速率逐漸增大,說明反應為放熱反應,
A.c點反應速率最大,但沒有達到平衡狀態,反應繼續向正反應方向進行,c點時轉化率不是最大,錯誤;
B.反應向正反應進行,隨著反應的進行,反應物濃度逐漸降低,故錯誤;
C、隨反應的進行,體系是的溫度越來越高,反應速率逐漸增大,當時間相同時,轉化率逐漸增大,正確,
故答案為:C;
(3)當a=b時,amol•L-1的氨水與b mol•L一1鹽酸等體積混合,反應后溶液呈酸性,若溶液顯中性,則酸的量要減少,故a>b.
反應后溶液顯中性,溶液中c(OH-)=1×10-7mol/L,根據電荷守恒溶液中c(NH4+)=c(Cl-)=$\frac{b}{2}$mol/L,反應前c(NH3•H2O)=$\frac{a}{2}$mol/L,
則反應后一水合氨的濃度為:c(NH3•H2O)=(a/2-b/2)mol/L,所以氨水的電離平衡常數為:K=$\frac{c(N{{H}_{4}}^{+})c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$═$\frac{b×1{0}^{-7}}{a-b}$mol/L;
故答案為:>;$\frac{{b×{{10}^{-7}}}}{a-b}mol•{L^{-1}}$.
點評 本題主要考查了物質的量或濃度隨時間的變化曲線、化學平衡常數的含義、化學平衡的影響因素、化學反應速率的影響因素、酸堿混合時的定性判斷及有關平衡常數的計算,中等難度,答題時注意電解質溶液基礎知識的靈活運用.


 開心蛙狀元作業系列答案
開心蛙狀元作業系列答案 課時掌控隨堂練習系列答案
課時掌控隨堂練習系列答案 一課一練一本通系列答案
一課一練一本通系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 2SO2(g)+2O2(g)?2SO3(g)是生產硫酸的主要反應之一.下表是原料氣按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa時,不同溫度下SO2的平衡轉化率.
2SO2(g)+2O2(g)?2SO3(g)是生產硫酸的主要反應之一.下表是原料氣按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa時,不同溫度下SO2的平衡轉化率.| 溫度/ | 400 | 500 | 600 |
| SO2轉化率/% | 99.2 | 93.5 | 73.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CO2+H2O=H2CO3 | B. | CaCO3$\frac{\underline{\;高溫\;}}{\;}$CO2↑+CaO | ||
| C. | CaCO3+2HCl=CaCl2+H2O+CO2↑ | D. | 2Na+Cl2$\frac{\underline{\;點燃\;}}{\;}$NaCl |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | c(Na+)+c(H+)=c(OH-)+2c(S2-)+c(HS-) | B. | c(OH-)=c(HS-)+c(H+)+2c(H2S) | ||
| C. | c(Na+)=2c(S2-)+2c(HS-)+2c(H2S) | D. | c(OH-)=c(HS-)+c(H+)+c(H2S) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com