
【題目】在標準狀況下,與16g O2的體積相等的N2為( )
A.體積為22.4LB.分子數為6.02×1024
C.質量為14gD.物質的量為1mol
科目:高中化學 來源: 題型:
【題目】KClO3和濃鹽酸在一定溫度下反應會生成黃綠色的易爆物二氧化氯。其變化可表述為2KClO3+4HCl(濃)=2KCl+Cl2↑+2ClO2↑+2H2O。
(1)請分析該反應中電子轉移的情況(用雙線橋表示)。_____
(2)濃鹽酸在反應中顯示出來的性質是________(填序號)。
①只有還原性 ②還原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)產生0.1molCl2,轉移電子的物質的量為________mol。
(4)ClO2具有很強的氧化性,因此常被用作消毒劑,其消毒的效率(以單位質量得到的電子數表示)是Cl2的_
_______倍。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某課外活動小組用如圖裝置進行實驗,試回答下列問題:

(1)若開始時開關K與a連接,則B極的電極反應為____________________。
(2)若開始時開關K與b連接,則B極的電極反應為____________________,總反應的離子方程式為____________________。
(3)有關上述實驗,下列說法正確的是______。
A.溶液中Na+向A極移動
B.從A極處逸出的氣體能使濕潤的KI淀粉試紙變藍
C.反應一段時間后加適量鹽酸可恢復到電解前電解質的濃度
D.若標準狀況下B極產生2.24 L氣體,則溶液中轉移0.2 mol電子
(4)該小組同學認為,如果模擬工業上離子交換膜法制燒堿的方法,那么可以設想用如圖裝置電解硫酸鉀溶液來制取氫氣、氧氣、硫酸和氫氧化鉀。
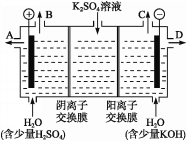
①該電解槽的陽極反應為______________。 此時通過陰離子交換膜的離子數_____(填“大于”“小于”或“等于”)通過陽離子交換膜的離子數。
②制得的氫氧化鉀溶液從出口(填“A”、“B”、“C”或 “D”)________導出。
③電解過程中陰極區堿性明顯增強,用平衡移動原理解釋原因__________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知水在25℃和95℃時,其電離平衡曲線如右圖所示:

(1)則25℃時水的電離平衡曲線應為__________(填“A”或“B”);
(2)25℃時,將![]() =11的NaOH溶液與
=11的NaOH溶液與![]() =4的
=4的![]() 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的![]() =9,則NaOH溶液與
=9,則NaOH溶液與![]() 溶液的體積比為____________;
溶液的體積比為____________;
(3)95℃時,若100體積![]() 1=
1=![]() 的某強酸溶液與1體積
的某強酸溶液與1體積![]() 2=b的某強堿溶液混合后溶液呈中性,則混合前,該強酸的
2=b的某強堿溶液混合后溶液呈中性,則混合前,該強酸的![]() 1與強堿的
1與強堿的![]() 2之間應滿足的關系是_______。
2之間應滿足的關系是_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某容器真空時,稱量其質量為60.4g,此容器充滿N2時總質量為66.0g,在相同狀況下,充滿另一氣體時,總質量為70g,那么該氣體可能是( )
A.Cl2B.O3C.SO2D.HCl
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有機反應屬于加成反應的是 ( )
A. CH4 + Cl2![]() CH3Cl + HCl
CH3Cl + HCl
B. 2CH3CH3+5O2![]() 2CO2+6H2O
2CO2+6H2O
C. ![]()
D. 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知A在通常狀況下是一種相對分子質量為28的氣體,其產量通常用來衡量一個國家的石油化工水平。B、D是飲食中兩種常見的有機物,現以A為主要原料合成一種具有果香味的乙酸乙酯F,F中碳原子數是D的兩倍。其合成路線如下圖所示。

請回答下列問題:
(1)寫出A的分子式為________,A中的所有原子是否共平面 ______(填“是”或“否”)。
(2)B、 D分子中的官能團名稱分別是____________、 _____________。
(3)寫出下列反應的化學方程式,并指出反應類型:
反應①:__________________________;___________。
反應②:__________________________;___________。
反應③:__________________________;___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某硫酸工業廢渣的主要成分為SiO2、MgO、Al2O3、Fe2O3等。回收廢渣中金屬元素的工藝流程如下:

已知常溫條件下:
①陽離子以氫氧化物形式開始沉淀和恰好完全沉淀(陽離子濃度等于10-5mol·L-1 )時的pH 如下表所
示。
陽離子 | Fe3+ | Al3+ | Mg2+ |
開始沉淀時的pH | 1.9 | 3.7 | 9.6 |
恰好完全沉淀時的pH | 3.2 | 5.2 | 11.0 |
②飽和氨水溶液中c(OH-)約為1×10-3mol·L-1。
請回答下列問題:
(1)固體C為_________(填化學式)。
(2)上述流程中兩次使用試劑X,試劑X是_________(填“氨水”或“氫氧化鈉”),其理由是_________________。
(3)溶液D→固體E的過程中需要控制溶液pH=13,如果pH過小,可能導致的后果是________________。
(4)寫出溶液F→溶液H 的離子方程式:__________________。
(5)Ksp[Mg (OH )2]=_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】N2O和CO是環境污染性氣體,可在Pt2O+表面轉化為無害氣體,其反應為N2O(g)+CO(g) CO2(g)+N2(g) △H,有關化學反應的物質變化過程(圖1)及能量變化過程(圖2)如下:

下列說法正確的是( )
A.由圖1可知:△H1=△H+△H2
B.由圖2可知△H =-226 kJ/mol
C.為了實現轉化需不斷向反應器中補充Pt2O+和Pt2O2+
D.由圖2可知該反應正反應的活化能大于逆反應的活化能
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com