
【題目】某烴A是有機化學工業的基本原料,其產量可以用來衡量一個國家的石油化工發展水平,A還是一種植物生長調節劑,A可發生如圖所示的一系列化學反應,其中①②③屬于同種反應類型。
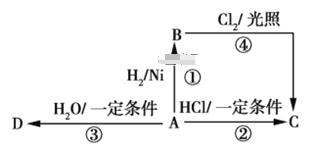
根據圖回答下列問題。
(1) 寫出A、B、C、D的結構簡式:
A_______,B_______,
C_______,D_______。
(2)寫出②、④兩步反應的化學方程式,并注明反應類型:②_______________,反應類型_________;
④__________________________,反應類型______。
【答案】(1)CH2=CH2CH3CH3CH3CH2Cl CH3CH2OH
(2)CH2===CH2+HCl![]() CH3CH2Cl 加成反應;
CH3CH2Cl 加成反應;
CH3CH3+Cl2![]() CH3CH2Cl+HCl 取代反應
CH3CH2Cl+HCl 取代反應
【解析】
烴A的產量可以用來衡量一個國家的石油化工發展水平,還是一種植物生長調節劑,故A為CH2=CH2,CH2=CH2與氫氣發生加成反應生成B,B為CH3CH3,乙烯與HCl發生加成反應生成C,C為CH3CH2Cl,乙烯與水發生加成反應生成D,D為CH3CH2OH,據此分析解答。
(1)由上述分析可知,A、B、C、D分別為CH2=CH2、CH3CH3、CH3CH2Cl、CH3CH2OH,故答案為:CH2═CH2;CH3CH3;CH3CH2Cl;CH3CH2OH;
(2)反應②為乙烯與HCl發生的加成反應,反應的化學方程式為CH2=CH2+HCl ![]() CH3CH2Cl;反應④為乙烷與氯氣的取代反應,反應的化學方程式為CH3CH3+Cl2
CH3CH2Cl;反應④為乙烷與氯氣的取代反應,反應的化學方程式為CH3CH3+Cl2 ![]() CH3CH2Cl+HCl,故答案為:CH2=CH2+HCl
CH3CH2Cl+HCl,故答案為:CH2=CH2+HCl ![]() CH3CH2Cl;加成反應;CH3CH3+Cl2
CH3CH2Cl;加成反應;CH3CH3+Cl2 ![]() CH3CH2Cl+HCl;取代反應。
CH3CH2Cl+HCl;取代反應。


科目:高中化學 來源: 題型:
【題目】下列關于電解質溶液的敘述正確的是
A. 向0.1mol/L的氨水中加入少量硫酸銨固體,則溶液中c(OH-)/c(NH3·H2O)增大
B. 常溫下,pH=7的NH4Cl與氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-)
C. 在pH相同的鹽酸和氯化銨溶液中水的電離程度相同
D. pH=11的NaOH溶液與pH=3醋酸溶液等體積混合,滴入石蕊溶液呈紅色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高純度單晶硅是典型的無機非金屬材料,又稱“半導體”材料,它的發現和使用曾引起計算機的一場“革命”。這種材料可以按下列方法制備,下列說法正確的是
SiO2 ![]() Si(粗)
Si(粗) 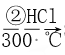 SiHCl3
SiHCl3 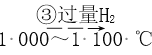 Si(純)
Si(純)
A. 步驟①的化學方程式為SiO2+C![]() Si+CO2↑
Si+CO2↑
B. 步驟①、②、③中每生成或反應1 mol Si,轉移2 mol電子
C. 二氧化硅能與氫氟酸反應,而硅不能與氫氟酸反應
D. SiHCl3(沸點33.0 ℃)中含有少量的SiCl4(沸點67.6 ℃),通過蒸餾可提純SiHCl3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】運用化學反應原理研究合成氨反應有重要意義,請完成下列探究。
(1)生成氫氣:將水蒸氣通過紅熱的炭即產生水煤氣。C(s)+H2O(g)![]() H2(g)+CO(g) ΔH=+131.3 kJ·mol-1,ΔS=+133.7 J·mol-1·K-1,該反應在低溫下________(“能”或“不能”)自發進行。
H2(g)+CO(g) ΔH=+131.3 kJ·mol-1,ΔS=+133.7 J·mol-1·K-1,該反應在低溫下________(“能”或“不能”)自發進行。
(2)已知在400 ℃時,N2(g)+3H2(g)![]() 2NH3(g)的K=0.5。
2NH3(g)的K=0.5。
①在400 ℃時,2NH3(g)![]() N2(g)+3H2(g)的K′=________(填數值)。
N2(g)+3H2(g)的K′=________(填數值)。
②400 ℃時,在0.5 L的反應容器中進行合成氨反應,一段時間后,測得N2、H2、NH3的物質的量分別為2 mol、1 mol、2 mol,則此時反應v正(N2)________(填“>”“<”“=”或“不能確定”)v逆(N2)。
③若在恒溫、恒壓條件下向平衡體系中通入氬氣,則合成氨反應的平衡________(填“向左”“向右”或“不”)移動;使用催化劑________(填“增大”“減小”或“不改變”)反應的ΔH。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】三個裝有CH4和Cl2 混合氣體的集氣瓶,用玻璃片蓋好瓶口后,分別作如下處理,各有怎樣的現象發生?
(1)①置于黑暗中: _____________________;
②將點燃的鎂條靠近集氣瓶外壁: ________________________;
③放在有光線的房子里: __________________________________。
(2)CH4和Cl2發生的一系列反應都是___________(填反應類型)反應,請寫出CH4和Cl2反應生成一氯甲烷的化學方程式: ________________________________。
(3)若要使0.5 mol CH4完全和Cl2發生取代反應,并生成相同物質的量的四種取代產物,則生成HCl的物質的量為_________。
A.2.5mol B.2mol C.1.25mol D.0.5mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學興趣小組利用NaI溶液中通入少量Cl2得到含碘廢液,再利用含碘廢液獲取NaI固體,實驗流程如下:

已知反應②:2I﹣+2Cu2++![]() +H2O
+H2O![]() 2CuI↓+
2CuI↓+![]() +2H+。
+2H+。
回答下列問題:
(1)過濾實驗所需要的玻璃儀器有普通漏斗、燒杯、_____________。
(2)反應③中CuI被氧化,還原產物只有NO2,該反應的化學方程式為_________________。當有95.5 g CuI參與反應,則需要標況下______________L的O2才能將生成的NO2在水中完全轉化為硝酸。
(3)化合物B中含兩種元素,鐵原子與另一種元素原子的物質的量之比為3∶8,則化合物B的化學式為_____________。
(4)反應⑤中生成黑色固體和無色氣體,黑色固體的俗稱為磁性氧化鐵,則反應⑤的化學方程式為______。
(5)將足量的Cl2通入含12 g NaI的溶液中,一段時間后把溶液蒸干得到固體的質量為_________g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】20℃時,配制一組c(H2A)+ c(HA-)+ c(A2-)=0.100 mol·L-1的H2A和NaOH混合溶液,溶液中部分微粒的物質的量濃度隨pH的變化曲線如圖所示。下列說法正確的是

A. H2A在水中的電離方程式為:H2A=HA-+ H+,HA-![]() H++A2-
H++A2-
B. c(Na+)=0.100 mol·L-1的溶液中,c(H+)+c(H2A)=c(OH-)+ c(A2-)
C. pH=4的溶液中,c(HA-)>c(H2A)+ c(A2-)
D. pH=7的溶液中,c(Na+)=2c(A2-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉛蓄電池反應為:Pb + PbO2 + 2H2SO4![]() 2PbSO4 + 2H2O 。下列說法中正確的是
2PbSO4 + 2H2O 。下列說法中正確的是
A. PbO2得電子,被氧化
B. 鉛蓄電池工作過程中每通過2mol電子,負極質量減少207g
C. 電流是由PbO2經外電路流向Pb
D. 電池放電時,溶液酸性增強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋰錳電池的體積小、性能優良,是常用的一次電池。該電池反應原理如圖所示,其中電解質LiClO4溶于混合有機溶劑中,Li+通過電解質遷移入MnO2晶格中,生成LiMnO2。
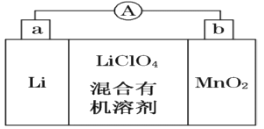
回答下列問題:
(1)外電路的電流方向是由______極流向______極。(填字母)
(2)電池正極反應式為 _____________________。
(3)MnO2可與KOH和KClO3在高溫下反應,生成K2MnO4,反應的化學方程式為 _________________。K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物質的量之比為__________。
(4)電解Na2CO3溶液,原理如圖所示。
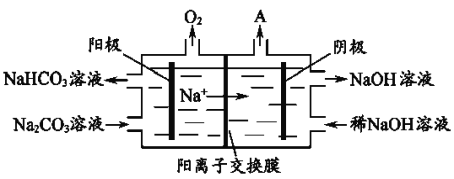
陽極的電極反應式為__________________,陰極產生的物質A的化學式為____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com