
 求出物質的量濃度;根據MgCl2的物質的量濃度以及1個MgCl2中含有2個氯離子求出Cl-的物質的量濃度,與溶液的體積無關.
求出物質的量濃度;根據MgCl2的物質的量濃度以及1個MgCl2中含有2個氯離子求出Cl-的物質的量濃度,與溶液的體積無關.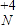
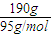 =2mol,則MgCl2物質的量濃度為C(MgCl2)
=2mol,則MgCl2物質的量濃度為C(MgCl2)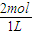 =2 mol/L,溶液中Cl-的物質的量濃度C(Cl-)=2C(MgCl2)=4mol/L,故答案為:2mol/L;4mol/L;
=2 mol/L,溶液中Cl-的物質的量濃度C(Cl-)=2C(MgCl2)=4mol/L,故答案為:2mol/L;4mol/L; =0.25L,故答案為:0.25L;
=0.25L,故答案為:0.25L; 

 學練快車道快樂假期寒假作業系列答案
學練快車道快樂假期寒假作業系列答案 新思維寒假作業系列答案
新思維寒假作業系列答案科目:高中化學 來源: 題型:


查看答案和解析>>
科目:高中化學 來源:2011-2012學年山西省太原市高三第一學段測評考試化學試卷 題型:填空題
(8分)某反應中反應物與生成物有:KClO3、K2SO4、H2C2O4、CO2、H2SO4、H2O和一種氧化物X。
(1)已知KClO3在反應中得到電子,則該反應的還原劑是 。
(2)已知0.2 mol KClO3在反應中得到0.2 mol電子生成X,則X的化學式為 。
(3)根據上述反應可推知 (填字母編號)。
a.氧化性:KClO3> CO2 b.氧化性:CO2> KClO3
c.還原性:H2C2O4>X d.還原性:X> H2C2O4
(4)寫出該反應的離子方程式: 。
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com