
分析 (1)堿性溶液能使紅色石蕊試紙變藍;
(2)碳酸根離子能和硝酸反應生成二氧化碳,硫酸根離子能和鋇離子反應生成硫酸鋇反應生成白色沉淀;
(3)白色不溶于硝酸的白色沉淀只有氯化銀和硫酸鋇,
綜上可得:溶液中一定含有OH-、Cl-;一定不含CO32-、SO42-,K+、Na+是否存在不能確定,可以采用焰色反應來鑒別是否存在.
解答 解:(1)用紅色石蕊試紙檢驗,試紙變藍色,則一定含有OH-;
(2)另取少量溶液加硝酸至過量,無氣體放出,則一定不含有CO32-,再加BaCl2溶液,無沉淀生成,則一定不含有SO42-;
(3)溶液用硝酸酸化后,加入硝酸銀溶液有白色沉淀生成,則該沉淀一定是氯化銀,一定含有Cl-;
綜上可得:溶液中一定含有OH-、Cl-;一定不含CO32-、SO42-,K+、Na+是否存在不能確定,可以采用焰色反應來鑒別是否存在,
(1)溶液中一定含有OH-、Cl-;一定不含CO32-、SO42-,K+、Na+是否存在不能確定,故答案為:OH-、Cl-;CO32-、SO42-;K+、Na+;
(2)鈉離子和鉀離子的檢驗可以采用焰色反應,用鉑絲蘸取溶液,在酒精燈火焰上灼燒,焰色反應為黃色火焰,說明含鈉離子,若隔著鈷玻璃觀察焰色反應為紫色火焰,證明含鉀離子,
故答案為:用鉑絲蘸取溶液,在酒精燈火焰上灼燒,焰色反應為黃色火焰,說明含鈉離子,若隔著鈷玻璃觀察焰色反應為紫色火焰,證明含鉀離子.
點評 本題考查了離子性質和檢驗,物質的檢驗是化學的難重點,也是考試的熱點之一,了解物質或離子的化學性質,是本題解題的關鍵,難度不大.


 備戰中考寒假系列答案
備戰中考寒假系列答案科目:高中化學 來源: 題型:選擇題
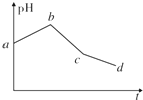 將物質的量濃度相等的KCl和CuSO4兩種溶液等體積混合后,用石墨電極進行電解,電解過程中,溶液pH隨時間t變化的曲線如上圖所示,則下列說法正確的是( )
將物質的量濃度相等的KCl和CuSO4兩種溶液等體積混合后,用石墨電極進行電解,電解過程中,溶液pH隨時間t變化的曲線如上圖所示,則下列說法正確的是( )| A. | ab段表示電解過程中H+被還原,pH上升 | |
| B. | 電解開始時陽極先發生電極反應2Cl--2e-═Cl2↑ | |
| C. | 電解至c點時,往電解液中加入適量CuCl2固體,即可使電解液恢復至原來的濃度 | |
| D. | 原混合溶液中KCl和CuSO4的濃度之比恰好為2:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 飽和氯水中:Cl-、NO3-、Na+、SO32- | |
| B. | c(H+)=1.0×10-13mol/L溶液中:S2-、K+、SO32-、Br- | |
| C. | Na2S溶液中:SO42-、K+、Cl-、Al3+ | |
| D. | pH=12的溶液中:NO3-、I-、Na+、Al3+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在標準狀況下,1mol任何物質的體積為22.4L | |
| B. | 等物質的量的HCl和 H 2 SO4中,H+的物質的量也相等 | |
| C. | 1molH 2和1molHe中,所含的分子數相同、原子數相同、質量也相同 | |
| D. | 體積為6L的 O 2,其質量可能為8g |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 水的電離程度不變 | B. | pH值變大 | ||
| C. | 稀釋過程中,所有離子濃度均變小 | D. | 稀釋過程中Kw逐漸變小 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 甲 | 乙 | ||
| 滴管中 | 燒瓶中 | 滴管中 | 燒瓶中 | |
| A | 水 | 鈉 | 飽和碳酸鈉溶液 | CO2 |
| B | 水 | 過氧化鈉 | 飽和碳酸氫鈉溶液 | CO2 |
| C | NaOH溶液 | 碳酸氫鈉 | 澄清石灰水 | 碳酸氫鈉 |
| D | 稀鹽酸 | 碳酸氫鈉 | FeCl3溶液 | Cu |
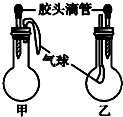
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗操作 | 實驗現象 | 結論 |
| A | 將濃硫酸滴到蔗糖表面 | 固體變黑膨脹 | 濃硫酸有脫水性 |
| B | 將鹽酸緩緩滴入Na2CO3溶液中 | 有氣泡產生 | 二者不反應 |
| C | 向某溶液中加入濃NaOH溶液并加熱,在試管口用濕潤紅色石蕊紙檢驗 | 試紙變藍 | 原溶液中含有NH4+ |
| D | 向氫氧化鐵膠體中滴加氯化銨飽和溶液 | 產生沉淀 | 沉淀為FeCl3 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 蒸餾、萃取、分液、過濾 | B. | 萃取、蒸餾、分液、蒸發 | ||
| C. | 萃取、蒸餾、分液、過濾 | D. | 蒸餾、萃取、分液、蒸發 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com