
【題目】合成氨反應過程中的能量變化如圖所示,下列說法正確的是
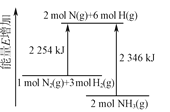
A.NH3的能量較低,比N2、H2更穩定
B.2NH3(g)→2N(g)+6H(g)-2346 kJ
C.N2(g)+3H2(g)![]() 2NH3(g)-92 kJ
2NH3(g)-92 kJ
D.加入催化劑,可以減小反應的熱效應
科目:高中化學 來源: 題型:
【題目】已知某反應的各物質濃度數據如下:
aA(g)+bB(g)![]() 2C(g)
2C(g)
起始濃度(mol·L-1) 3.0 1.0 0
2 s末濃度(mol·L-1) 1.8 0.6 0.8
據此可推算出上述反應化學方程式中,各物質的化學計量數之比是( )
A. 9∶3∶4B. 3∶1∶2C. 2∶1∶3D. 3∶2∶1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2019年諾貝爾化學獎頒給了三位為鋰離子電池發展作出重要貢獻的科學家。磷酸鐵鋰鋰離子電池充電時陽極反應式為,![]() ,放電工作示意圖如圖。下列敘述不正確的是
,放電工作示意圖如圖。下列敘述不正確的是
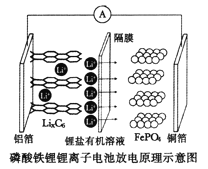
A.放電時,Li+通過隔膜移向正極
B.放電時,電子由鋁箔沿導線流向銅箔
C.放電時正極反應為:![]()
D.磷酸鐵鋰鋰離子電池充放電過程通過Li+遷移實現,C、Fe、P元素化合價均不發生變化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉍及其化合物在工業生產中用途廣泛,某研究小組用浮選過的輝鉍礦(主要成分是Bi2S3,還含少量Bi2O3、SiO2等雜質)制備鉍酸鈉,其流程如下:
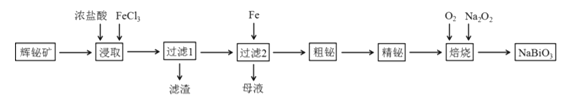
已知:①鉍酸鈉是一種難溶于水的物質;②水解能力:Bi3+>Fe3+。
回答下列問題:(1)“浸取”時,為了提高浸取速率,可采取的措施有______(任寫一條);過濾1的濾渣中的某種主要成分可溶于一種弱酸,寫出該反應的化學方程式______。
(2)浸取時加入過量濃鹽酸的目的是______;“母液”中通入氣體X后可循環利用,氣體X為______(填名稱)。
(3)寫出焙燒時生成鉍酸鈉的化學方程式______。
(4)用![]() 雙硫腙,二元弱酸
雙硫腙,二元弱酸![]() 絡合萃取法可從工業廢水中提取金屬離子:
絡合萃取法可從工業廢水中提取金屬離子:![]() 先將金屬離子絡合成電中性的物質
先將金屬離子絡合成電中性的物質![]() 如
如![]() 等
等![]() ,再用
,再用![]() 萃取此絡合物。圖2是用上述方法處理含有
萃取此絡合物。圖2是用上述方法處理含有![]() 、
、![]() 、
、![]() 的廢水時的酸度曲線(E%表示金屬離子以絡合物形式被萃取分離的百分率)。
的廢水時的酸度曲線(E%表示金屬離子以絡合物形式被萃取分離的百分率)。
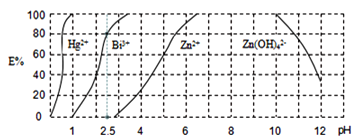
①當![]() :
:![]() :4時,廢水的
:4時,廢水的![]() ______。
______。
②向萃取后的![]() 中加入足量的NaOH溶液可將鉍元素以氫氧化物的形式沉淀下來,相應的離子方程式為___。
中加入足量的NaOH溶液可將鉍元素以氫氧化物的形式沉淀下來,相應的離子方程式為___。
(5)取焙燒得到的![]() 樣品
樣品![]() ,加入稀硫酸和
,加入稀硫酸和![]() 溶液使其完全溶解。已知
溶液使其完全溶解。已知![]() 被還原為
被還原為![]() ,
,![]() 被氧化成成
被氧化成成![]() ,試寫出該反應的離子方程式:____。然后用新配制的
,試寫出該反應的離子方程式:____。然后用新配制的![]() 溶液對生成的
溶液對生成的![]() 進行滴定,滴定完成后稍耗
進行滴定,滴定完成后稍耗![]() 溶液。則該樣品中
溶液。則該樣品中![]() 純度為____。
純度為____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CoCl2·6H2O是一種飼料營養強化劑。一種利用水鈷礦(主要成分為Co2O3、Co(OH)3,還含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工藝流程如下:

已知:①浸出液中含有的陽離子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分陽離子以氫氧化物形式沉淀時溶液的pH見下表:(金屬離子濃度為:0.01mol/L)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
開始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2·6H2O熔點為86℃,加熱至110~120℃時,失去結晶水生成無水氯化鈷。
(1)寫出浸出過程中Co2O3發生反應的離子方程式______________。
(2)寫出NaClO3發生反應的主要離子方程式______________;若不慎向“浸出液”中加過量NaClO3時,可能會生成有毒氣體,寫出生成該有毒氣體的離子方程式_____________。
(3)“加Na2CO3調pH至a”,過濾所得到的兩種沉淀的化學式為___________。
(4)制得的CoCl2·6H2O在烘干時需減壓烘干的原因是__________________。
(5)萃取劑對金屬離子的萃取率與pH的關系如圖。向“濾液”中加入萃取劑的目的是_________;其使用的最佳pH范圍是________________。
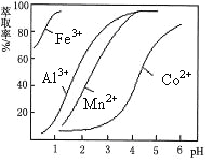
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)為測定粗產品中CoCl2·6H2O含量,稱取一定質量的粗產品溶于水,加入足量AgNO3溶液,過濾、洗滌,將沉淀烘干后稱其質量。通過計算發現粗產品中CoCl2·6H2O的質量分數大于100%,其原因可能是________________。(答一條即可)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮和硫的化合物在工農業生產、生活中具有重要應用。請回答下列問題:
(1)航天領域中常用N2H4作為火箭發射的助燃劑。N2H4與氨氣相似,是一種堿性氣體,易溶于水,生成弱堿N2H4·H2O。用電離方程式表示N2H4·H2O顯堿性的原因是:____________________________________________。
(2)在恒溫條件下,1 mol NO2和足量C發生反應2NO2(g)+2C(s)![]() N2(g)+2CO2(g),測得平衡時NO2和CO2的物質的量濃度與平衡總壓的關系如圖所示:
N2(g)+2CO2(g),測得平衡時NO2和CO2的物質的量濃度與平衡總壓的關系如圖所示:
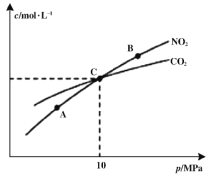
①A、B兩點的濃度平衡常數關系:Kc(A) ___________Kc(B)(填“<”或“>”或“=”)
②A、B、C三點中NO2的轉化率最高的是___________(填“A”或“B”或“C”)點。
③計算C點時該反應的壓強平衡常數Kp=___________MPa(Kp是用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)。
(3)已知:亞硝酸(HNO2)性質和硝酸類似,但它是一種弱酸。常溫下亞硝酸的電離平衡常數Ka=5.1×10-4;H2CO3的Ka1=4.2×10-7,Ka2=5.61×10-11。在常溫下向含有2mol碳酸鈉的溶液中加入1mol的HNO2后,則溶液中CO32-、HCO3-和NO2-的離子濃度由大到小的順序是______________________。
(4)已知:常溫下甲胺(CH3NH2)的電離常數為Kb,且pKb=-lgKb=3.4水溶液中有CH3NH2+H2OCH3NH3++OH-。常溫下向CH3NH2溶液滴加稀硫酸至c(CH3NH2)=c(CH3NH3+)時,則溶液pH=_______。
(5)一種煤炭脫硫技術可以把硫元素以CaSO4的形成固定下來,但產生的CO又會與CaSO4發生化學反應,相關的熱化學方程式如下:
①CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g) △H=+210.5kJ· mol-1
②CaSO4(s)+4CO(g) CaS(s)+ 4CO2(g) △H=-189.2 kJ· mol-1
反應CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g) △H=___________ kJ· mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應的產物中,有的有同分異構體,有的沒有同分異構體,其中產物一定不存在同分異構體的反應是 ( )
A.異戊二烯[CH2=C(CH3)CH=CH2]與等物質的量的Br2發生加成反應
B.1—丁烯(CH3CH2CH=CH2)與HCl分子發生的加成反應
C.甲苯在一定條件下發生硝化生成一硝基甲苯的反應
D.苯甲酸(![]() )與NaHCO3溶液反應
)與NaHCO3溶液反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮的氧化物是造成大氣污染的主要物質。研究氮氧化物的反應機理對于消除環境污染有重要意義。
(1)NO在空氣中存在如下反應:2NO(g)+O2(g)![]() 2NO2(g) △H,上述反應分兩步完成,其反應歷程如下圖所示:
2NO2(g) △H,上述反應分兩步完成,其反應歷程如下圖所示:

回答下列問題:
①寫出反應I的熱化學方程式_________。
②反應I和反應Ⅱ中,一個是快反應,會快速建立平衡狀態,而另一個是慢反應。決定2NO(g)+O2(g)![]() 2NO2(g)反應速率的是_______(填“反應I”或“反應Ⅱ”);對該反應體系升高溫度,發現總反應速率反而變慢,其原因可能是__________(反應未使用催化劑)。
2NO2(g)反應速率的是_______(填“反應I”或“反應Ⅱ”);對該反應體系升高溫度,發現總反應速率反而變慢,其原因可能是__________(反應未使用催化劑)。
(2)用活性炭還原法處理氮氧化物的有關反應為:C(s)+2NO(g)![]() N2(g)+CO2(g)。向恒容密閉容器中加入一定量的活性炭和NO,T℃時,各物質起始濃度及10min和20min各物質平衡濃度如表所示:
N2(g)+CO2(g)。向恒容密閉容器中加入一定量的活性炭和NO,T℃時,各物質起始濃度及10min和20min各物質平衡濃度如表所示:

①T℃時,該反應的平衡常數為_____________________(保留兩位有效數字)。
②在10min時,若只改變某一條件使平衡發生移動,20min時重新達到平衡,則改變的條件是__________________________________。
③在20min時,保持溫度和容器體積不變再充入NO和N2,使二者的濃度均增加至原來的兩倍,此時反應v正_______v逆(填“>”、“<”或“=”)。
(3)NO2存在如下平衡:2NO2(g)![]() N2O4(g) △H<0,在一定條件下NO2與N2O4的消耗速率與各自的分壓(分壓=總壓×物質的量分數)有如下關系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相應的速率與其分壓關系如圖所示。
N2O4(g) △H<0,在一定條件下NO2與N2O4的消耗速率與各自的分壓(分壓=總壓×物質的量分數)有如下關系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相應的速率與其分壓關系如圖所示。

一定溫度下,k1、k2與平衡常數kp(壓力平衡常數,用平衡分壓代替平衡濃度計算)間的關系是k1=____________;在上圖標出點中,指出能表示反應達到平衡狀態的點是___,理由是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
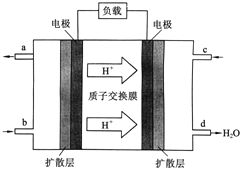
【題目】中國科學院長春應用化學研究所在甲醇燃料電池技術方面獲得新突破,組裝出了自呼吸電池及主動式電堆![]() 甲醇燃料電池的工作原理如圖所示.
甲醇燃料電池的工作原理如圖所示.
![]() 該電池工作時,b口通入的物質為______,c口通入的物質為______.
該電池工作時,b口通入的物質為______,c口通入的物質為______.
![]() 該電池負極的電極反應式為:______.
該電池負極的電極反應式為:______.
![]() 工作一段時間后,當
工作一段時間后,當![]() 甲醇完全反應生成
甲醇完全反應生成![]() 時,有______
時,有______![]() 個電子轉移.
個電子轉移.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com