
| ⅠA | ⅧA | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑧ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
 ;
;分析 由元素早周期表中位置,可知①為H、②為C、③為N、④為O、⑤為Na、⑥為P、⑦為S、⑧為Ne、⑨為Cl,
(1)元素④在周期表中位置,可知其處于第二周期ⅥA族;容易獲得電子;
(2)同周期從左到右非金屬性增強、同主族自上而下非金屬性減弱,非金屬性越強,氣態氫化物越穩定;
(3)離子的電子層數相同時,核電荷數越大,離子半徑越小;
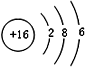
(4)元素⑦是S元素,硫原子核外有16個電子,有3個電子層,各層電子數為2、8、6;
(5)高氯酸的酸性最強;上述元素中Na的金屬性最強,化學性質最穩定的為稀有氣體.
解答 解:由元素早周期表中位置,可知①為H、②為C、③為N、④為O、⑤為Na、⑥為P、⑦為S、⑧為Ne、⑨為Cl,
(1)元素④處于第二周期ⅥA族,為氧元素;氧元素容易獲得電子,表現氧化性,
故答案為:氧;氧化;
(2)同周期從左到右非金屬性增強、同主族自上而下非金屬性減弱,故非金屬性:O>S>P,非金屬性越強,氣態氫化物越穩定,故氫化物穩定性:H2O>H2S>PH3,
故答案為:H2O>H2S>PH3;
(3)元素③④⑤分別為N、O、Na,形成的離子分別為N3-、O2-、Na+,離子的電子層數相同,核電荷數越大,離子半徑越小,則離子半徑由大到小的順序是:N3->O2->Na+,
故答案為:N3->O2->Na+;
(4)元素⑦是S元素,硫原子核外有16個電子,有3個電子層,各層電子數為2、8、6,原子結構示意圖為: ,
,
故答案為: ;
;
(5)高氯酸的酸性最強,其化學式為HClO4;上述元素中化學性質最穩定的為稀有氣體Ne;金屬性最強的為金屬Na,
故答案為:HClO4;Ne;Na.
點評 本題考查了位置結構與性質關系的應用,題目難度不大,明確元素周期表結構為解答關鍵,注意掌握常見化學用語的概念及書寫原則,試題側重基礎知識的考查,培養了學生的分析能力及靈活應用能力.


 寒假大串聯黃山書社系列答案
寒假大串聯黃山書社系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 手持試管給試管里的物質加熱 | |
| B. | 用天平稱量藥品時,用手直接取放砝碼 | |
| C. | 用pH試紙測定溶液的酸堿性時,一定要先把試紙用蒸餾水潤濕一下 | |
| D. | 兩端有大、小兩匙的藥匙,取用很少量的氧化銅粉末時應用小匙 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | J | F | H | I |
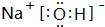 ;酸性最強的是HClO4,呈兩性的是Al(OH)3;
;酸性最強的是HClO4,呈兩性的是Al(OH)3;查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 元素 | 相關信息 |
| X | 原子核內無中子 |
| Y | 組成蛋白質的基礎元素,其最高正化合價與最低負化合價的代數和為2 |
| Z | 地殼中含量最高的元素 |
| W | 原子質量數為23,中子數為12 |
| R | 其離子是第三周期金屬元素的離子中半徑最小的 |
 ,X、Y、Z形成的化合物可用作化肥,該物質所含化學鍵的類型是離子、共價(填共價或離子);X與Z形成的18e-微粒的結構式為H-O-O-H.
,X、Y、Z形成的化合物可用作化肥,該物質所含化學鍵的類型是離子、共價(填共價或離子);X與Z形成的18e-微粒的結構式為H-O-O-H.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1:1:1 | B. | 1:2:7 | C. | 4:2:7 | D. | 2:4:7 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 26g的苯和乙炔的混合物最多可以與2mol的氫氣發生加成 | |
| B. | 某溫度下,MgCO3的Ksp=4×10-6,則飽和溶液中含Mg2+數目為2×10-3NA | |
| C. | 標準狀況下,NA個NO分子和0.5NA個O2分子充分反應后氣體體積為22.4 L | |
| D. | 氫氣與氯氣反應生成標準狀況下22.4 L氯化氫,斷裂化學鍵總數為1NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com