


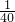 ,得到x=8ml,選擇量筒是100ml,
,得到x=8ml,選擇量筒是100ml, ×10-3+
×10-3+ ×10-3)mol,
×10-3)mol, ×100%=
×100%= ×100%
×100% ×100%.
×100%.

 中考解讀考點精練系列答案
中考解讀考點精練系列答案 各地期末復習特訓卷系列答案
各地期末復習特訓卷系列答案科目:高中化學 來源: 題型:閱讀理解


| 65×(V2+V3)×10-3 |
| 22.4×m |
| 65×(V2+V3)×10-3 |
| 22.4×m |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

| 11m-3b |
| 11m |
| 11m-3b |
| 11m |
m-
| ||
| m |
m-
| ||
| m |
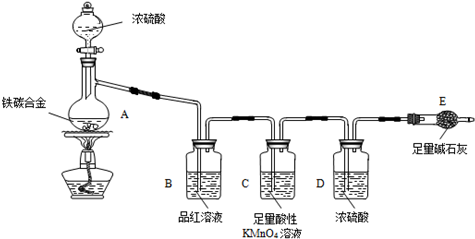
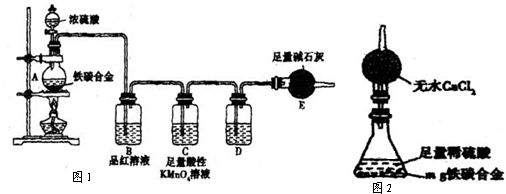
 (5)經過大家的討論,決定采用下圖裝置(干燥管中試劑為無水氯化鈣,錐形瓶中為mg鐵炭合金和足量稀硫酸.)和其他常用實驗儀器測定某些數據即可.為了快速測算出鐵的質量分數,最簡便的實驗操作是
(5)經過大家的討論,決定采用下圖裝置(干燥管中試劑為無水氯化鈣,錐形瓶中為mg鐵炭合金和足量稀硫酸.)和其他常用實驗儀器測定某些數據即可.為了快速測算出鐵的質量分數,最簡便的實驗操作是查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com