
| A. | 在反應①和②中,氯化鈉均既是氧化劑,又是還原劑 | |
| B. | 在反應①中氯氣是還原產物,在反應②中氫氣是還原產物 | |
| C. | 若標準狀況下生成等體積的氣體,則反應①和②中轉移電子總數相等 | |
| D. | 若消耗等質量的氯化鈉,則反應①和②中轉移電子總數相等 |
分析 ①電解熔融氯化鈉制鈉:2NaCl(熔融)$\frac{\underline{\;電解\;}}{\;}$2Na+Cl2↑,Na元素的化合價降低,Cl元素的化合價升高,所以氯化鈉既是氧化劑,又是還原劑;
②電解飽和食鹽水制燒堿:2NaCl+2H2O$\frac{\underline{\;電解\;}}{\;}$2NaOH+H2↑+Cl2 ↑,H元素的化合價降低,Cl元素的化合價升高,所以水是氧化劑,氯化鈉是還原劑;據此分析.
解答 解:①電解熔融氯化鈉制鈉:2NaCl(熔融)$\frac{\underline{\;電解\;}}{\;}$2Na+Cl2↑,Na元素的化合價降低,Cl元素的化合價升高,所以氯化鈉既是氧化劑,又是還原劑;
②電解飽和食鹽水制燒堿:2NaCl+2H2O$\frac{\underline{\;電解\;}}{\;}$2NaOH+H2↑+Cl2 ↑,H元素的化合價降低,Cl元素的化合價升高,所以水是氧化劑,氯化鈉是還原劑;
A.由分析可知,反應②中氯化鈉是還原劑,故A錯誤;
B.在反應①中氯氣是氧化產物,在反應②中氫氣是還原產物,故B錯誤;
C.2NaCl(熔融)$\frac{\underline{\;電解\;}}{\;}$2Na+Cl2↑中生成1mol氣體轉移2mol電子,2NaCl+2H2O$\frac{\underline{\;電解\;}}{\;}$2NaOH+H2↑+Cl2 ↑中生成2mol氣體轉移2mol電子,故C錯誤;
D.若消耗1mol氯化鈉,則反應①和②中轉移電子均為2mol,所以消耗等質量的氯化鈉,則反應①和②中轉移電子總數相等,故D正確.
故選D.
點評 本題考查氧化還原反應,把握反應中的元素化合價變化為解答的關鍵,側重氧化劑、還原劑以及轉移電子的考查,題目難度不大.


 名題金卷系列答案
名題金卷系列答案科目:高中化學 來源: 題型:實驗題
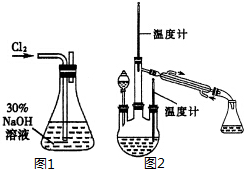 肼是重要的化工原料.某探究小組利用下列反應制取水合肼(N2H4•H2O).
肼是重要的化工原料.某探究小組利用下列反應制取水合肼(N2H4•H2O).查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 化學鍵的斷裂和形成是化學反應能量變化的主要原因 | |
| B. | 伴有能量變化的物質變化都是化學變化 | |
| C. | 在一個確定的化學反應中,反應物的總能量與生成物的總能量一定不同 | |
| D. | 在一個確定的化學反應中,反應物的總能量總是高于生成物的總能量 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | pH=14的溶液 | |
| B. | c(OH-)=1.0×10-13mol•L-1的溶液 | |
| C. | 0.6%的醋酸(ρ=1g•cm-3) | |
| D. | pH=2的鹽酸與pH=12的氫氧化鋇溶液等體積混合后所得溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
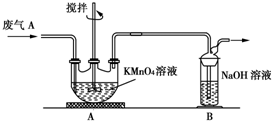 ①為了保證實驗成功,裝置A應具有的現象是KMnO4溶液的紫紅色不能完全褪色,攪拌的目的是提高SO2的吸收率.
①為了保證實驗成功,裝置A應具有的現象是KMnO4溶液的紫紅色不能完全褪色,攪拌的目的是提高SO2的吸收率.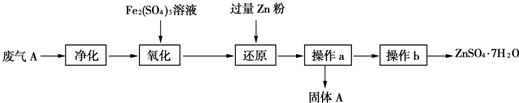
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | CH3CH2OH→CH3COOCH2CH3 | B. | CH2=CH2→CH3-CH2Br | ||
| C. | CH2=CH2+H2O $\stackrel{催化劑}{→}$ CH3CH2OH | D. |  → → |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com