
【題目】能用鍵能大小解釋的是( )
A.稀有氣體一般很難發生化學反應
B.常溫常壓下,氟氣的密度小于氯氣
C.相同條件下,NH3在水中的溶解度大于PH3
D.SiC晶體的熔點比晶體硅的高
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】下表是某學生為探究AgCl沉淀轉化為Ag2S沉淀的反應所做實驗的記錄.
步 驟 | 現 象 |
Ⅰ.取5mL 0.1mol/L AgNO3與一定體積0.1mol/L NaCl溶液,混合,振蕩. | 立即產生白色沉淀 |
Ⅱ.向所得懸濁液中加入2.5mL 0.1mol/L Na2S溶液. | 沉淀迅速變為黑色 |
Ⅲ.將上述黑色濁液,放置在空氣中,不斷攪拌. | 較長時間后,沉淀變為乳白色 |
Ⅳ.濾出Ⅲ中的乳白色沉淀,加入足量HNO3溶液. | 產生紅棕色氣體,沉淀部分溶解 |
Ⅴ.過濾得到濾液X和白色沉淀Y;向X中滴加Ba(NO3)2溶液. | 產生白色沉淀 |
(1)為了證明沉淀變黑是AgCl轉化為Ag2S的緣故,步驟I中NaCl溶液的體積范圍為 .
(2)已知:25℃時Ksp(AgCl)=1.8×10﹣10 , Ksp(Ag2S)=6×10﹣30 , 此沉淀轉化反應的平衡常數K .
(3)步驟V中產生的白色沉淀的化學式為 , 步驟Ⅲ中乳白色沉淀除含有AgCl外,還含有 .
(4)為了進一步確認步驟Ⅲ中乳白色沉淀產生的原因,設計了如下圖所示的對比實驗裝置. ①裝置A中玻璃儀器有圓底燒瓶、導管和 , 試劑W為 .
②裝置C中的試劑為NaCl溶液和Ag2S懸濁液的混合物,B中試劑為 .
③實驗表明:C中沉淀逐漸變為乳白色,B中沒有明顯變化.
完成C中反應的化學方程式:
Ag2S+NaCl++AgCl+S+
C中NaCl的作用是:
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】惰性電極電解NaCl溶液或CuSO4溶液都得到三種產物A、B、C,各物質之間的轉化關系如下圖所示(圖中參與反應和生成的水都已略去)。已知甲是短周期元素的單質,它是日常生活中常用的包裝材料。
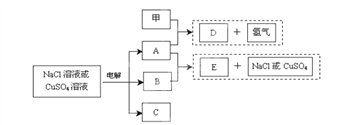
回答下列問題:
(1)若電解的是NaCl溶液:
①甲與A反應的化學方程式是________________________________。
②E與少量CO2反應的離子方程式是________________________________。
③常溫下,若電解100mL 0.1 mol/L NaCl溶液,陰、陽兩極各產生112mL氣體(標準狀況),則所得溶液的pH為___(忽略反應前后溶液的體積變化及氣體溶于水的影響)。
(2)若電解的是CuSO4溶液,加熱時,A的濃溶液可與B發生反應:
①A的濃溶液與B反應過程中,A的濃度隨時間變化的圖像正確是_________。

②E的化學式是______________;電解時陽極的電極反應式是___________________。
③若CuSO4溶液足量,電解后要恢復原來的濃度可加入 ________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關熱化學方程式書寫及對應表述均正確的是( )
A.密閉容器中,9.6g硫粉與11.2g鐵粉混合加熱生成硫化亞鐵17.6 g時,放出19.12 kJ熱量.則Fe(s)+S(s)═FeS(s)△H=﹣95.6kJ/mol
B.稀醋酸與0.1 mol/LNaOH溶液反應:H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJ/mol
C.已知1 mol氫氣完全燃燒生成液態水所放出的熱量為285.5 kJ,則水分解的熱化學方程式:2H2O(l)═2H2(g)+O2(g)△H=+285.5kJ/mol
D.已知2C(s)+O2 (g)═2CO(g)△H=﹣221kJ/mol,則可知C的燃燒熱△H=﹣110.5kJ/mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.乙烯和苯使溴水褪色的原理相同
B.甲烷和乙烯都可以與氯氣反應
C.乙醇與Na反應比水與Na反應劇烈
D.乙烯可以與氫氣發生加成反應,苯不能與氫氣加成
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現欲用純凈的鋅粒與稀鹽酸反應制取H2 , 請回答:
(1)實驗過程如圖所示,分析判斷:段鹽酸濃度變化最快,段消耗HCl的物質的量最多,段化學反應速率最慢. 
(2)為了降低上述化學反應的反應速率,欲向溶液中加入下列物質,你認為可行的是 .
A.蒸餾水
B.NaCl固體
C.NaCl溶液
D.濃鹽酸
(3)除了上述方法外,你認為還可以采取哪些措施來降低化學反應速率? .
(4)從反應速率的變化可以看出該反應過程中(填“放出”或“吸收”)熱量.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com