
【題目】短周期元素A、B、C、D、E原子序數依次增大。A是周期表中原子半徑最小的元素,B原子的最外層電子數等于該元素最低化合價的絕對值,C與D能形成D2C和D2C2兩種化合物,而D是同周期中金屬性最強的元素,E的負一價離子與C和A形成的某種化合物分子含有相同的電子數。
(1)A、C、D形成的化合物中含有的化學鍵類型為___________________;
(2)已知:①E-E→2E;△H=+a kJmol-1
②2A→A-A;△H=-b kJmol-1
③E+A→A-E;△H=-c kJmol-1(“”表示形成共價鍵所提供的電子)
寫出298K時,A2與E2反應的熱化學方程式___________________;
(3)在某溫度下、容積均為2L的三個密閉容器中,按不同方式投入反應物,保持恒溫恒容,使之發生反應:2A2(g)+BC(g)X(g);△H=-d Jmol-1(d>0,X為A、B、C三種元素組成的一種化合物).初始投料與各容器達到平衡時的有關數據如下:
實驗 | 甲 | 乙 | 丙 |
初始投料 | 2mol A2、1mol BC | 1mol X | 4mol A2、2mol BC |
平衡時n(X) | 0.5mol | n2 | n3 |
反應的能量變化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
體系的壓強 | P1 | P2 | P3 |
反應物的轉化率 | α1 | α2 | α3 |
①該溫度下此反應的平衡常數K的值為_____;
②三個容器中的反應分別達平衡時各組數據關系正確的是_____(填序號)
A.α1+α2=1 B.α3<α1 C.n2<n3<1.0mol D.P3<2P1=2P2 E.Q1+Q2=d F.Q3=2Q1
(4)在其他條件不變的情況下,將甲容器的體系體積壓縮到1L,若在第8min達到新的平衡時A2的總轉化率為65.5%,請在下圖中畫出第5min到新平衡時X的物質的量濃度的變化曲線。

【答案】(1)離子鍵、共價鍵 (2)H2(g)+Cl2(g)=2HCl(g)△H=(a+b-2c) kJmol-1
(3)① 4 ②ADE (4)
【解析】
試題分析:短周期元素A、B、C、D、E原子序數依次增大,A是周期表中原子半徑最小的元素,則A為氫元素;D是同周期中金屬性最強的元素,處于ⅠA族,D的原子序數比H元素至少大3,可推知D為Na元素;B原子的價電子數等于該元素最低化合價的絕對值,處于ⅣA族,結合原子序數可知,B為碳元素;C與D能形成D2C和D2C2兩種化合物,則C為O元素;E形成負一價離子,則E為Cl,氯離子與H2O2含有相同的電子數;(1)A、C、D形成的化合物為NaOH,屬于離子化合物,氫氧根離子中氧原子與氫原子之間形成共價鍵,故含有離子鍵、共價鍵;(2)已知:①Cl-Cl→2Cl;△H=+a kJmol-1 ②2H→H-H;△H=-b kJmol-1 ③Cl+H→H-Cl;△H=-c kJmol-1, 根據蓋斯定律,①-②+③×2得:H2(g)+Cl2(g)=2HCl(g)△H=(a+b-2c) kJmol-1;(3)①CO的起始濃度=![]() =0.5mol/L,氫氣的起始濃度=
=0.5mol/L,氫氣的起始濃度=![]() =1mol/L,達到平衡時c(CH3OH)=
=1mol/L,達到平衡時c(CH3OH)=![]() =0.25mol/L,則:
=0.25mol/L,則:
CO(g)+2H2(g)CH3OH(g)
起始(mol/L):0.5 1 0
變化(mol/L):0.25 0.5 0.25
平衡(mol/L):0.25 0.5 0.25
所以:平衡常數k═![]() =4;
=4;
②A.甲、乙為等效平衡,平衡時CO的物質的量相等,令平衡時CO為amol,甲中CO轉化率α1=![]() =1-a,平衡時甲醇的物質的量=(1-a)mol,乙中參加反應的甲醇為amol,乙中的轉化率α2=a,故α1+α2=1,故A正確;B.丙與甲相比,可以等效為在甲的基礎上,壓強增大一倍,平衡向正反應方向移動,轉化率增大,即α3>α1 ,故B錯誤;C.由D中分析可知,n2=0.5,n3>1.0mol,故C錯誤;D.甲、乙為等效平衡,平衡時對應各組分的物質的量相等,二者壓強等效,丙與甲相比,可以等效為在甲的基礎上,壓強增大一倍,平衡向正反應移動,平衡時混合氣體的物質的量小于甲中的2倍,故壓強P3<2P1=2P2 ,故D正確;E.甲、乙為等效平衡,平衡時CO的物質的量相等,令平衡時CO為bmol,則甲中參加反應的CO為(1-b)mol,放出的熱量Q1=d(1-b),乙中參加反應的甲醇為bmol,吸收的熱量Q2=bd,故Q1+Q2=d(1-b)+bd=d,故E正確;F.丙與甲相比,可以等效為在甲的基礎上,壓強增大一倍,平衡向正反應移動,丙中參加反應的CO的物質的量大于甲中的2倍,則Q3>2Q1,故F錯誤,故答案為ADE。
=1-a,平衡時甲醇的物質的量=(1-a)mol,乙中參加反應的甲醇為amol,乙中的轉化率α2=a,故α1+α2=1,故A正確;B.丙與甲相比,可以等效為在甲的基礎上,壓強增大一倍,平衡向正反應方向移動,轉化率增大,即α3>α1 ,故B錯誤;C.由D中分析可知,n2=0.5,n3>1.0mol,故C錯誤;D.甲、乙為等效平衡,平衡時對應各組分的物質的量相等,二者壓強等效,丙與甲相比,可以等效為在甲的基礎上,壓強增大一倍,平衡向正反應移動,平衡時混合氣體的物質的量小于甲中的2倍,故壓強P3<2P1=2P2 ,故D正確;E.甲、乙為等效平衡,平衡時CO的物質的量相等,令平衡時CO為bmol,則甲中參加反應的CO為(1-b)mol,放出的熱量Q1=d(1-b),乙中參加反應的甲醇為bmol,吸收的熱量Q2=bd,故Q1+Q2=d(1-b)+bd=d,故E正確;F.丙與甲相比,可以等效為在甲的基礎上,壓強增大一倍,平衡向正反應移動,丙中參加反應的CO的物質的量大于甲中的2倍,則Q3>2Q1,故F錯誤,故答案為ADE。
(4)將甲容器的體系體積壓縮到1L,若在第8min 達到新的平衡時,
2H2(g)+CO(g)CH4O(g)
初始量:2 1 0
變化量:1.31 0.655 0.655
平衡量:0.69 0.345 0.655
所以達到平衡時,甲醇的物質的量濃度是0.655mol/L,在第5min時,由于體積減半,所以甲醇的濃度
應該加倍,即為0.25mol/L×2=0.5mol/L,所以5-8min內,甲醇的物質的量濃度從0.5mol/L升高到0.655mol/L,如圖所示: 。
。


科目:高中化學 來源: 題型:
【題目】在t℃時,Ag2CrO4(橘紅色)在水溶液中的沉淀溶解平衡曲線如下圖所示。 又知AgCl的Ksp=1.8×10-10。下列說法正確的是( )
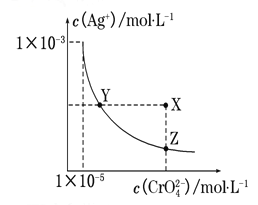
A.t℃時,Ag2CrO4的Ksp為1×10-8
B.在飽和Ag2CrO4溶液中加入K2CrO4能使溶液由Y點變為X點
C.t℃時,Y點和Z點時Ag2CrO4的Ksp相等
D.t℃時,將0.01 mol·L-1 AgNO3溶液滴入20 mL 0.01 mol·L-1 KCl和0.01 mol·L-1 K2CrO4的混合溶液中,CrO42-先沉淀
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】前四周期原子序數依次增大的六種元素A、B、C、D、E、F中,A+無電子,B的最簡單氣態氫化物能引起溫室效應,D原子核外電子有8種不同的運動狀態, E是用途最廣泛的金屬,F元素的基態原子最外能層只有一個電子,其它能層均已充滿電子。
(1)E元素在周期表中的位置 ;F+的電子排布式為 。
(2)化合物BD(CA2)2中,B原子的雜化方式為 ,1mol該分子中σ鍵數目為 個,該物質易溶于水的主要原因是 _ _____________。
(3)ACD3中陰離子CD3-的空間構型為 ,ACD3酸性比ACD2強,原因是___________。
(4)根據等電子體原理,BD分子的電子式為 ,E與BD形成的化合物E(BD)5熔點253K,沸點376K,其固體屬于 晶體。
(5)3g B2A6在足量氧氣中燃燒并恢復到室溫,放出Q kJ熱量,則表示B2A6燃燒熱的熱化學方程式為
______ _ _____________。
(6)將F單質粉末加入到CA3的濃溶液中,并通入D2,充分反應后溶液呈深藍色,寫出該反應的化學方程式 _ _____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室以苯甲醛為原料制備間溴苯甲醛(實驗裝置見下圖,相關物質的物理性質見附表)。
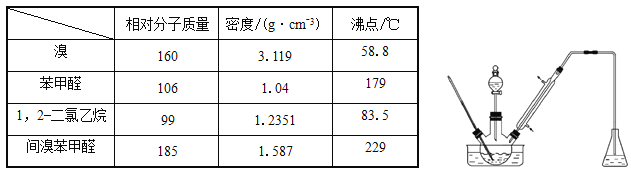
其實驗步驟為:
步驟1:將三頸瓶中的一定配比的無水AlCl3、1,2-二氯乙烷和苯甲醛(5.3g)充分混合后,升溫至60℃,緩慢滴加經濃硫酸干燥過的液溴,保溫反應一段時間,冷卻。
步驟2:將反應混合物緩慢加入一定量的稀鹽酸中,攪拌、靜置、分液。有機相用10%NaHCO3溶液洗滌。
步驟3:經洗滌的有機相加入適量無水硫酸鈣固體,放置一段時間后過濾。
步驟4:為了防止間溴苯甲醛因溫度過高被氧化,把步驟3處理得到的間溴苯甲醛加入少量鋅粉,同時采用某種技術,收集相應餾分,其中收集到間溴苯甲醛為3.7g 。
(1)實驗裝置中采用的加熱方式為_______,冷凝管的作用為_______,錐形瓶中的試劑應為________。
(2)步驟1所加入的無水AlCl3的作用為_________。
(3)步驟2中用10%NaHCO3溶液洗滌有機相,是為了除去溶于有機相的______(填化學式)。
(4)步驟3中加入的無水硫酸鈣固體的目的是_______________。
(5)步驟4中,某種技術為__________________。
(6)本實驗所得到的間溴苯甲醛產率是_______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電解原理在化學工業中有廣泛應用。右圖表示一個電解池,裝有電解液a;X、Y是兩塊電極板,通過導線與直流電源相連。請回答以下問題:
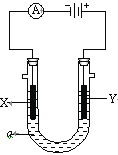
(1)若X、Y都是惰性電極,a是飽和NaCl溶液,實驗開始時,同時在兩邊各滴入幾滴酚酞試液,則
① 電解池中X極上的電極反應式為 。在X極附近觀察到的現象是 。
② Y電極上的電極反應式為 ,檢驗該電極反應產物的方法是 。
(2)如要用電解方法精煉粗銅,電解液a選用CuSO4溶液,
① X電極的材料是 ,電極反應式是 。
② Y電極的材料是 ,電極反應式是 。(說明:雜質發生的電極反應不必寫出)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮及其化合物在工業生產和國防建設中有廣泛應用。回答下列問題:
(1)氮氣性質穩定,可用作保護氣。請用電子式表示氮氣的形成過程:
。
(2)聯氨(N2H4)是一種還原劑。已知:H2O(l)=H2O(g) △H=+44kJ/mol。試結合下表數據,寫出N2H4 (g)燃燒熱的熱化學方程式: 。
化學鍵 | N—H | N—N | N=N | N≡N | O=O | O—H |
鍵能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
(3)KCN可用于溶解難溶金屬鹵化物。將AgI溶于KCN溶液中,形成穩定的Ag(CN)2—,該轉化的離子方程式為: 。若已知Ksp(AgI)=1.5×10—16,K穩[Ag(CN)2—]=1.0×10-21,則上述轉化方程式的平衡常數K= 。(提示:K穩越大,表示該化合物越穩定)
(4)氨的催化氧化用于工業生產硝酸。該反應可設計成新型電池,試寫出堿性環境下,該電池的負極電極反應式: 。
(5)將某濃度的NO2氣體充入一恒容絕熱容器中,發生反應2NO2![]()
![]() N2O4其相關圖像如下。
N2O4其相關圖像如下。

①0~3s時v(NO2)增大的原因是 。
②5s時NO2轉化率為 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸鋅可作為食品鋅強化劑的原料。工業上常用菱鋅礦生產硫酸鋅,菱鋅礦的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3MgO、CaO等,生產工藝流程圖如下:

(1)將菱鋅礦研磨成粉的目的是_____。
(2)完成“氧化除鐵”步驟中反應的離子方程式:□Fe(OH)2+□____+□_____=□Fe(OH)3+□CI-
(3)針鐵礦(Goethite)是以德國詩人歌德(Goethe)名字命名的,組成元素是Fe、O和H,摩爾質量為89g/mol,化學式是_______。以Al和NiO(OH)為電極,NaOH溶液為電解液組成一種新型電池,放電時針鐵礦轉化為Fe(OH)2,該電池放電反應的化學方程式是__________。
(4)根據下表數據,調節“濾液2”的pH時,理論上可選用的最大區間為______。
沉淀化學式 | Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 |
開始沉淀的pH | 10.4 | 6.4 | — | — |
沉淀完全的pH | 12.4 | 8.0 | — | — |
開始溶解的pH | — | 10.5 | — | — |
Ksp | 5.6× | — | 6.8× | 2.8× |
(5)工業上從“濾液3”制取MgO過程中,合適的反應物是______(選填序號)。
a.大理石粉 b.石灰乳 c.純堿溶液 d.氨水
(6)“濾液4”之后的操作依次為______、_______、過濾,洗滌,干燥。
(7)分析圖中數據,菱鋅礦粉中ZnCO3的質量分數不低于________(用代數式表示)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在t℃時,AgBr在水中的沉淀溶解平衡曲線如圖所示。又知t℃時AgCl的Ksp=4×10-10,下列說法不正確的是

A. 在t℃時,AgBr的Ksp為4.9×10-13
B. 在AgBr飽和溶液中加入NaBr固體,可使溶液由c點到b點
C. 圖中a點對應的是AgBr的不飽和溶液
D. 在t℃時,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)平衡常數K≈816
AgBr(s)+Cl-(aq)平衡常數K≈816
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有A、B、C、D、E 5種元素,它們的核電荷數依次增大,且都小于20。其中C、E是金屬元素;A和E屬同一族,它們原子的最外層電子排布為ns1。B和D也屬同一族,它們原子最外層的p能級電子數是s能級電子數的兩倍,C原子最外層上電子數等于D原子最外層上電子數的一半。請回答下列問題:
(1)由這五種元素組成的一種化合物是(寫化學式)________________________。
(2)寫出C元素基態原子的電子排布式_________________________。
(3)用軌道表示式表示D元素原子的價電子構型____________________。
(4)元素B與D的電負性的大小關系是___________,C與E的第一電離能的大小關系是___________。(填﹥、﹤、﹦,并且用元素符號表示)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com