
氫能源是一種重要的清潔能源。現有兩種可產生H2的化合物甲和乙。將6.00 g甲加熱至完全分解,只得到一種短周期元素的金屬單質和6.72 L的H2(已折算成標準狀況)。甲與水反應也能放出H2,同時還產生一種白色沉淀物,該白色沉淀可溶于NaOH溶液。化合物乙在催化劑存在下可分解得到H2和另一種單質氣體丙,丙在標準狀況下的密度為1.25 g·L-1請回答下列問題:
(1)甲的化學式是________;乙的電子式是________。
(2)甲與水反應的化學方程式是________。
(3)氣體丙與金屬鎂反應的產物是________(用化學式表示)。
(4)乙在加熱條件下與CuO反應可生成Cu和氣體丙,寫出該反應的化學方程式__________________。有人提出產物Cu中可能還混有Cu2O,請設計實驗方案驗證之______________________。
(已知:Cu2O+2H+=Cu+Cu2++H2O)
(5)甲與乙之間________(填“可能”或“不可能”)發生反應產生H2,判斷理由是________。
(1)AlH3 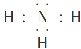
(2)AlH3+3H2O=Al(OH)3+3H2↑
(3)Mg3N2
(4)2NH3+3CuO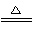 3Cu+N2+3H2O 取樣后加稀H2SO4,如果溶液變藍,說明產物中含有Cu2O,反之則無Cu2O
3Cu+N2+3H2O 取樣后加稀H2SO4,如果溶液變藍,說明產物中含有Cu2O,反之則無Cu2O
(5)可能 AlH3中的氫化合價為-1價,NH3中的氫為+1價,因而有可能發生氧化還原反應生成氫氣
【解析】根據甲受熱分解及與水的反應確定其組成,根據丙的密度確定丙和化合物乙的組成,再結合各小題進行分析、解答。
(1)6.00 g甲加熱至完全分解,只得到一種短周期元素的金屬單質和6.72 L H2(即0.3 mol),說明甲為金屬氫化物。甲與水反應生成的白色沉淀物可溶于NaOH溶液,則該沉淀物為Al(OH)3,結合甲分解過程中的質量變化,可推知甲為AlH3。單質氣體丙在標準狀況下的密度為1.25 g·L-1,則M(丙)=1.25 g·L-1×22.4 L·mol-1=28 g·mol-1,則丙為N2,乙為NH3。
(2)AlH3與水反應生成Al(OH)3和H2,反應的化學方程式為AlH3+3H2O=Al(OH)3+3H2↑。
(3)N2與金屬Mg在點燃條件下發生反應,生成Mg3N2。
(4)NH3具有還原性,與CuO在加熱條件下發生反應,生成Cu、N2和H2O,反應方程式為2NH3+3CuO 3Cu+N2+3H2O。由于Cu2O在酸性環境中可發生自身氧化還原反應,生成Cu2+和Cu,可向產物中滴加稀鹽酸或稀硫酸,由于Cu與非氧化性酸不發生反應,若得到藍色溶液,則證明含有Cu2O,反之則不含Cu2O。
3Cu+N2+3H2O。由于Cu2O在酸性環境中可發生自身氧化還原反應,生成Cu2+和Cu,可向產物中滴加稀鹽酸或稀硫酸,由于Cu與非氧化性酸不發生反應,若得到藍色溶液,則證明含有Cu2O,反之則不含Cu2O。
(5)AlH3中H元素為-1價,NH3中H元素為+1價,根據氧化還原反應規律,二者可能發生價態歸中的氧化還原反應,生成H2。
點撥:知識:物質的推斷,氧化還原反應,元素及其化合物。能力:考查考生的邏輯分析能力、綜合推斷能力、信息加工處理能力和遷移應用能力。試題難度:中等。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:2013-2014學年高考化學二輪復習必做訓練 綜合實驗設計與評價練習卷(解析版) 題型:實驗題
制備氮化鎂的裝置示意圖如下:

回答下列問題:
(1)檢查裝置氣密性的方法是__________________________,
a的名稱是________,b的名稱是________。
(2)寫出NaNO2和(NH4)2SO4反應制備氮氣的化學方程式________________________________。
(3)C的作用是________,D的作用是________,是否可以把C與D的位置對調并說明理由________。
(4)寫出E中發生反應的化學方程式____________________。
(5)請用化學方法確定是否有氮化鎂生成,并檢驗是否含有未反應的鎂,寫出實驗操作及現象___________________________________
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習必做訓練 電化學原理及其應用練習卷(解析版) 題型:填空題
硫酸銅在工農業生產和生活中都有重要的應用。請回答下列問題:
(1)銅與濃硫酸共熱是制備硫酸銅的方法之一,寫出反應的化學方程式:__________________。但該反應生成的氣體污染環境。為避免環境污染,可在銅粉與稀硫酸的混合物中通入熱空氣,反應的總化學方程式為____________________。
(2)將銅粉置于稀硫酸中不發生反應,加入雙氧水,則銅粉可逐漸溶解。寫出反應的離子方程式:____________________。
(3)將適量稀硝酸分多次加入到銅粉與稀硫酸的混合物中,加熱使之反應完全,通過蒸發、結晶可得到硫酸銅晶體。為了節約原料,H2SO4和HNO3的物質的量之比最佳為________________。
(4)用惰性電極電解硫酸銅溶液,實驗裝置如圖甲所示。圖乙是電解過程中產生氣體的總體積V與轉移電子的物質的量n(e-)的關系圖。

電解過程中,a電極的現象是______________;b電極的電極反應式為____________________。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習必做訓練 物質結構與性質練習卷(解析版) 題型:填空題
利用15N可以測定亞硝酸鹽對地下水質的污染情況。
(1)下列說法正確的是________。
A.14N與15N為同種核素
B.14N的第一電離能小于14C
C.15NH3與14NH3均能形成分子間氫鍵
D.CH315NH2與CH3CH214NH2互為同系物
(2)15N的價層電子排布圖為________;15NH4Cl的晶胞與CsCl相同,則15NH4Cl晶體中15NH4+的配位數為________;15NH4+中15N的雜化軌道類型為________。

(3)工業上電解法處理亞硝酸鹽的模擬工藝如圖。已知陽極區發生化學反應:
2NO2—+8H++6Fe2+=N2↑+6Fe3++4H2O
①陽極電極反應方程式是________(不考慮后續反應);
②若硫酸溶液濃度過大,陰極區會有氣體逸出,該氣體為_______
(填化學式);該現象表明c(H+)越大,H+氧化性越________;
③若電解時電路中有0.6 mol電子轉移,且NaNO2有剩余,則電解池中生成Na2SO4________mol。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習必做訓練 物質結構與性質練習卷(解析版) 題型:選擇題
下列數據是對應物質的熔點(℃):
BCl3 | Al2O3 | Na2O | NaCl | AlF3 | AlCl3 | 干冰 | SiO2 |
-107 | 2 073 | 920 | 801 | 1 291 | 190 | -57 | 1 723 |
據此做出的下列判斷中錯誤的是( )
A.鋁的化合物的晶體中有的是離子晶體
B.表中只有BCl3和干冰是分子晶體
C.同族元素的氧化物可形成不同類型的晶體
D.不同族元素的氧化物可形成相同類型的晶體
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習必做訓練 物質結構、元素周期律練習卷(解析版) 題型:選擇題
X、Y、Z、W是短周期的元素,原子序數依次遞增。X與Z位于同一主族,Y元素的單質既能與鹽酸反應也能與NaOH溶液反應,Z原子的最外層電子數是次外層電子數的一半,Y、Z、W原子的最外層電子數之和為14。下列說法正確的是( )
A.原子半徑由小到大的順序為X<Y<Z<W
B.Z的最高價氧化物能與水反應生成相應的酸
C.X、Z、W最高價氧化物對應水化物酸性的強弱順序為Z<X<W
D.室溫下,0.1 mol/L W的氣態氫化物的水溶液的pH>1
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習必做訓練 物質的量及其應用練習卷(解析版) 題型:選擇題
FeCl3可用作印刷電路銅板腐蝕劑。為回收廢腐蝕液中的銅,必須對廢腐蝕液的組成進行分析。某同學取廢腐蝕液200 mL,分成甲、乙兩等份。向甲溶液中滴加AgNO3溶液至不再有沉淀產生,得到沉淀129.15 g;向乙溶液中加入10 g足量鐵粉,充分反應,剩余固體質量4.8 g。計算中忽略溶液體積的變化。
(1)廢腐蝕液中Cl-的物質的量濃度是________。
(2)廢腐蝕液中Cu2+的物質的量濃度是________。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習必做訓練 物質的組成性質分類及化學用語練習卷(解析版) 題型:選擇題
下列關于物質的性質與用途的說法中不正確的是( )
A.氧化鋁的熔點很高,因此可用作耐火材料
B.某些金屬化合物灼燒時有特殊的顏色,因此可用于制造煙花
C.氫氟酸能與二氧化硅反應,因此可用于刻蝕玻璃
D.氯氣具有強氧化性,因此可用于漂白有色布料
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習必做訓練 化工生產流程、無機物的判斷練習卷(解析版) 題型:選擇題
二氧化硅(SiO2)又稱硅石,是制備硅及其化合物的重要原料,其相關轉化關系如圖所示,下列說法正確的是( )

A.SiO2屬于兩性氧化物
B.盛放Na2CO3溶液的試劑瓶不能用玻璃塞
C.硅膠吸水后不能重復再生
D.圖中所示轉化反應都是氧化還原反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com