
【題目】中藥在世界醫學界越來越受到關注。中藥藥劑砒霜(主要成分As2O3)可用于治療急性白血病,為此,砷及其化合物的提取再次引起關注。
(1)As是33號元素,在元素周期表中的位置是________。
(2)N元素非金屬性比As強,下列說法正確的是_______
①熱穩定性:NH3<AsH3
②酸性:HNO3>H3AsO4
③原子半徑:N<As
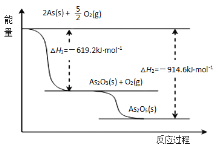
(3)請依據如圖信息寫出As2O5分解為As2O3的熱化學方程式_______。
(4)查閱文獻得知,可以從硫化砷(As2S3)廢渣中提取As2O3,提取的工藝流程簡圖如圖:

已知:As2S3不溶于水;As2O3微溶于水。
①As2S3、Na3AsS3中的硫元素均為-2價,堿浸過程中發生的反應______(填“是”或“不是”)氧化還原反應。
②過程Ⅲ的離子方程式為_______。
③過程Ⅲ得到純凈As2O3固體的系列操作包括_____、_____、_____。
④過程Ⅲ中,其它條件相同時僅改變溶液pH,發現酸性越強,As2O3的產率越高,可能的原因是_______。
【答案】第四周期VA族 ②③ As2O5(s)=As2O3(s)+O2(g) △H=+295.4kJ/mol 不是 2AsO43-+2SO2+2H+=As2O3↓+2SO42-+H2O 過濾 洗滌 干燥 酸性越強,物質的氧化性或者還原性可能增強;增加氫離子濃度,反應速率加快或者增加氫離子濃度,平衡正向移動促進反應的進行,有利于提高As2O3的產率
【解析】
(1)As的原子結構示意圖為:![]() ,有4個電子層,最外層有5個電子,與N同族,故位于第四周期V A族;
,有4個電子層,最外層有5個電子,與N同族,故位于第四周期V A族;
(2)元素非金屬性越強,對應氫化物的熱穩定性越好,最高價氧化物對應水化物的酸性越強,As電子層數比N多2,非金屬性N>As;
(3)根據蓋斯定律可知,反應熱與過程無關,只與始態、終態有關,由圖可知:△H+|△H1|=|△H2|,據此計算;
(4)堿浸過程中沒有元素化合價的變化,過程Ⅲ為溶液到固體,需要經過濃縮結晶,過濾,洗滌,烘干,發生反應的離子方程式為2AsO43-+2SO2+2H+=As2O3+2SO42-+H2O,酸性越強,物質的氧化性或者還原性可能增強;增加氫離子濃度平衡正向移動促進反應的進行,有利于提高As2O3的產率。
(1)As的原子結構示意圖有4個電子層,最外層有5個電子,位于第四周期,V A族;
(2)元素非金屬性越強,對應氫化物的熱穩定性越好,最高價氧化物對應水化物的酸性越強,非金屬性N>As,①NH3的熱穩定性比AsH3好,②HNO3的酸性比H3AsO4強,③As電子層數比N多2,N的原子半徑比As的原子半徑小,故答案為:②③;
(3)根據蓋斯定律可知,反應熱與過程無關,只與始態、終態有關,由圖可知:△H+|△H1|=|△H2|,△H=|△H2||△H1|==914.6kJ/mol619.2kJ/mol= +295.4kJ/mol,故該反應的熱化學方程式為:As2O5(s)==As2O3(s)+O2(g) △H= +295.4kJ/mol;
(4)①堿浸過程中沒有元素化合價的變化,故該反應不是氧化還原反應;
②過程Ⅲ發生反應的離子方程式為2AsO43-+2SO2+2H+=As2O3↓+2SO42-+H2O;
③過程Ⅲ為溶液到固體,需要經過濃縮結晶,過濾,洗滌,干燥;
④酸性越強,物質的氧化性或者還原性可能增強;增加氫離子濃度,反應速率加快或者增加氫離子濃度,平衡正向移動促進反應的進行,有利于提高As2O3的產率。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】科學家提出如下光分解法制備氫氣:
①2Ce4+(aq)+H2O(l)===2Ce3+(aq)+![]() O2(g)+2H+(aq) ΔH1
O2(g)+2H+(aq) ΔH1
②Ce3+(aq)+H2O(l)===Ce4+(aq)+![]() H2(g)+OH-(aq) ΔH2
H2(g)+OH-(aq) ΔH2
③H2O(l)===H+(aq)+OH-(aq) ΔH3
④2H2O(l)===2H2(g)+O2(g) ΔH4
下列說法正確的是( )
A. Ce4+能夠增大水分解反應的活化能,提高反應速率
B. Ce3+是反應②和反應③的催化劑
C. 上述反應中,ΔH4=2ΔH1+4ΔH2-4ΔH3
D. 通常條件下,反應④中生成H2、O2的速率之比為1∶2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示,燒杯中盛有水,鐵圈和銀圈直接相連,在接頭處用一根絕緣細絲吊住使之平衡。小心向燒杯中滴加少量CuSO4溶液,反應一段時間。下列有關說法不正確的是
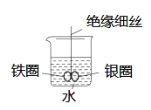
A.兩圈搖擺不定
B.鐵圈不斷腐蝕
C.銀圈上慢慢看到有紅色物質覆蓋
D.利用該原理,可以設計原電池裝置,將化學能轉化為電能
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,向濃度為0.1mol·L-1、體積為VL的氨水中逐滴加入一定濃度的鹽酸,用pH計測溶液的pH隨鹽酸的加入量而降低的滴定曲線,d點兩種溶液恰好完全反應。根據圖中信息回答下列問題:
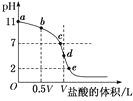
(1)該溫度時NH3·H2O的電離常數K=__;
(2)比較b、c、d三點時的溶液中,由水電離出的OH-濃度大小順序為__;
(3)滴定時,由b點到c點的過程中,下列各選項中數值保持不變的是__(填字母,下同);
A.c(H+)·c(OH-) B.![]() C.
C.![]() D.
D.![]()
(4)根據以上滴定曲線,下列說法正確的是__;
A.點b所示溶液中:c(NH![]() )+c(H+)=c(OH-)+c(NH3·H2O)
)+c(H+)=c(OH-)+c(NH3·H2O)
B.點c所示溶液中:c(Cl-)=c(NH3·H2O)+c(NH![]() )
)
C.點d所示溶液中:c(Cl-)>c(H+)>c(NH![]() )>c(OH-)
)>c(OH-)
D.滴定過程中可能有:c(NH3·H2O)>c(NH![]() )>c(OH-)>c(Cl-)>c(H+)
)>c(OH-)>c(Cl-)>c(H+)
(5)滴定過程中所用鹽酸的pH=___,d點之后若繼續加入鹽酸至圖像中的e點(此時不考慮NH4+水解的影響,忽略混合時溶液體積變化),則e點對應的橫坐標為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以太陽能為熱源分解Fe3O4,經熱化學鐵氧化合物循環分解水制H2的過程如圖所示。下列敘述不正確的是( )

A. 過程Ⅰ中的能量轉化形式是太陽能→化學能
B. 過程Ⅰ中每消耗116 g Fe3O4轉移2 mol電子
C. 過程Ⅱ的化學方程式為3FeO+H2O![]() Fe3O4+H2↑
Fe3O4+H2↑
D. 鐵氧化合物循環制H2具有節約能源、產物易分離等優點
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】科學家一直致力于“人工固氮”的新方法研究。
Ⅰ.目前合成氨技術原理為:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1。
2NH3(g) △H=-92.4kJ·mol-1。
(1)在一定體積的容器中發生上述反應,下列描述中能說明該反應已達平衡的是______
A.容器內氣體的平均摩爾質量保持不變
B.2v(NH3)正=v(N2)逆
C.容器中氣體的壓強保持不變
D.N2、H2、NH3的物質的量之比為1:2:3
(2)673K、30MPa下,向容積為2.0L的恒容密閉容器中充入0.80mol N2和1.60mol H2,反應3分鐘達到平衡時,NH3的體積分數為20%。
①該條件下反應:N2(g)+3H2(g)![]() 2NH3(g)的平衡常數K=_____(精確到小數點后一位);K值越大,表明反應達到平衡時______
2NH3(g)的平衡常數K=_____(精確到小數點后一位);K值越大,表明反應達到平衡時______
A.H2的轉化率一定越高 B.NH3的濃度一定越大
C.正反應進行得越完全 D.化學反應速率越大
②若達平衡后再向該容器中充入0.40mol N2和0.40mol NH3,該平衡將______(填“向正反應方向移動”、“向逆反應方向移動”或“不移動”)。
Ⅱ.根據“人工固氮”的最新研究報道,在常溫、常壓、光照條件下,N2在催化劑(摻有少量Fe2O3的TiO2)表面與水發生下列反應:2N2(g)+6H2O(1)![]() 4NH3(g)+3O2(g) △H=a kJ·mol-1。進一步研究NH3生成量與溫度的關系,常壓下達到平衡時測得部分實驗數據如表:
4NH3(g)+3O2(g) △H=a kJ·mol-1。進一步研究NH3生成量與溫度的關系,常壓下達到平衡時測得部分實驗數據如表:
T/K | 303 | 313 | 323 |
NH3的生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
(1)此合成反應的a_____0;ΔS______0,(填“>”、“<”或“=”)。
(2)已知(K為平衡常數):N2(g)+3H2(g)![]() 2NH3(g) K1,2H2(g)+O2(g)=2H2O(l) K2,則N2(g)+3H2O(1)=2NH3(g)+O2(g)的K=______(用K1、K2表示)。
2NH3(g) K1,2H2(g)+O2(g)=2H2O(l) K2,則N2(g)+3H2O(1)=2NH3(g)+O2(g)的K=______(用K1、K2表示)。
Ⅲ.已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(1) ΔH= -1316kJ·mol-1,氨是一種潛在的清潔能源,可用作堿性燃料電池的燃料,該燃料電池的負極反應式是_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】KMnO4是一種高效氧化劑可用來氧化吸附有機異味物.也可以與水中的雜質如二價鐵、錳、硫、氰、酚等反應。實驗室常用Na2C2O4標準溶液標定未知濃度的KMnO4溶液,發生反應:5C2O42-+2MnO4-+16H++4H2O=2[Mn(H2O)6]2++10CO2↑。根據以上信息,完成下列問題:
(1)按電子排布K位于元素周期表的_______區,基態Mn2+的核外電子排布式可表示為_____。
(2)1 mol [Mn( H2O)6]2+中所含有的共價鍵數目為__________。
(3)基態C原子的核外電子中占據最高能級的電子云輪廓圖為_______.C2O42-中碳原子的軌道雜化類型是___________________.
(4)同主族元素氧、硫、硒對應最簡單氫化物的沸點:H2O>H2Se>H2S,原因是__________。
(5)β-MnSe的結構中Se為面心立方最密堆積,晶胞結構如圖所示。
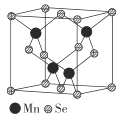
①β-MnSe中Mn的配位數為_____________。
②若該晶體的晶胞參數為apm,阿伏加德羅常數的值為NA。則距離最近的兩個錳原子之間的距離為______pm, β-MnSe 的密度ρ= ______ ( 列出表達式)g·cm-3。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫常壓下,某烴和氧氣的混合氣體4L,點燃后恰好完全燃燒,通過濃硫酸后恢復到原來狀態,體積變為2L。則符合題意的某烴為( )
A.C4H8B.C3H8C.C2H2D.CH4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】通常情況下,NCl3是一種油狀液體,其分子空間構型與NH3相似,下列對NCl3和NH3的有關敘述正確的是( )
A. 分子中N—Cl鍵鍵長與CCl4分子中C—Cl鍵鍵長相等
B. NCl3分子是非極性分子
C. NBr3比NCl3易揮發
D. 在氨水中,大部分NH3與H2O以氫鍵(用“…”表示)結合形成NH3·H2O分子,則NH3·H2O的結構式為![]()
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com