
【題目】下列物質中既能與稀H2SO4反應,又能與NaOH溶液反應的是( )
①Al ②Fe2O3 ③Na2CO3 ④Al(OH)3 ⑤NaHCO3
A.①②④B.②③⑤C.②④⑤D.①④⑤
 小學課時特訓系列答案
小學課時特訓系列答案科目:高中化學 來源: 題型:
【題目】化合物A能使溴水褪色,E能與NaHCO3反應,且標準狀況下1molE與足量Na反應能產生11.2L氣體。A的一系列反應如下(部分反應條件及產物略去):
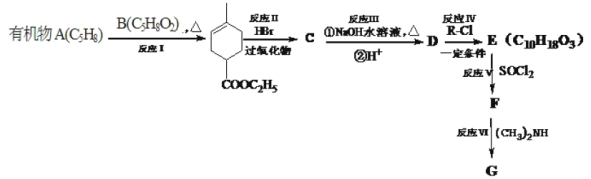
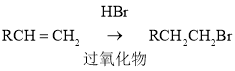
已知:
(1)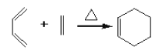
(2)
(3)![]()
回答下列問題:
(1)寫出化合物E的結構簡式________
(2)下列說法不正確的是________。
A. 有機物B中官能團的是碳碳雙鍵和酯基 B. 有機物C的分子式為C10H17O2Br
C. 反應Ⅲ、Ⅳ、Ⅴ、Ⅵ均屬于取代反應 D. 1mol有機物D最多可消耗2molNaOH
(3)寫出F→G反應的化學方程式________。
(4)寫出C5H9NO2滿足下列條件的所有鏈狀同分異構體的結構簡式__________。
①紅外光譜檢測表明分子中含有醛基;②1H-NMR譜顯示分子中有3種氫原子。
(5)![]() 是化工生產中的重要原料,請設計以有機物A為原料合成
是化工生產中的重要原料,請設計以有機物A為原料合成![]() 的合成路線________(用流程圖表示,無機試劑任選)。
的合成路線________(用流程圖表示,無機試劑任選)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.重鉻酸鉀(K2Cr2O7)是一種強氧化劑,在實驗室和工業中都有很廣泛的應用。同時,由于其具有致癌作用,也是環境污染物之一,必須進行處理。工業上通常以鉻鐵礦(主要成分為FeO·Cr2O3,另外還含有SiO2、Al2O3等雜質)為原料制備重鉻酸鉀,主要流程如下圖所示:

已知:①NaFeO2遇水強烈水解,生成紅褐色物質;
②2CrO42- (黃色)+2H+![]() Cr2O72- (橙色)+H2O。
Cr2O72- (橙色)+H2O。
請回答下列問題:
(1)濾液1的溶質除Na2CrO4、Na2SiO3外,還含有________________(填化學式);
(2)由濾液2轉化為Na2Cr2O7溶液過程中,能說明反應達平衡狀態的是________(填字母代號);
a.溶液的顏色不變
b.v(CrO![]() )=2v(Cr2O
)=2v(Cr2O![]() )
)
c.Cr2O![]() 和CrO
和CrO![]() 的濃度相同
的濃度相同
(3)向Na2Cr2O7溶液中加入KCl固體,獲得K2Cr2O7晶體的操作依次是加熱濃縮、______________、過濾、洗滌、干燥。
Ⅱ.工業廢水中常含有一定量的Cr2O![]() 和CrO
和CrO![]() ,常用還原沉淀法處理。該方法的工藝流程為:
,常用還原沉淀法處理。該方法的工藝流程為:
CrO![]()
![]() Cr2O
Cr2O![]()
![]() Cr3+
Cr3+![]() Cr(OH)3
Cr(OH)3
(4)請寫出Cr2O![]() 與FeSO4溶液在酸性條件下反應的離子方程式:______________________。
與FeSO4溶液在酸性條件下反應的離子方程式:______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設![]() 為阿伏加德羅常數的值,下列說法正確的是( )
為阿伏加德羅常數的值,下列說法正確的是( )
A. 3.0g甲醛和乙酸的混合物中所含的原子數為![]()
B. ![]() 與
與![]() 充分反應,轉移的電子數為
充分反應,轉移的電子數為![]()
C. ![]() 的稀硫酸中含有的氫離子數目為
的稀硫酸中含有的氫離子數目為![]()
D. 4.6g有機物![]() 的分子結構中碳氫鍵數目一定為
的分子結構中碳氫鍵數目一定為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲、乙、丙、丁均為中學化學常見的物質,它們之間的轉化關系如圖(反應條件及其它產物已略去).下列說法不正確的是( )
![]()
A. 若甲是AlCl3溶液,則丁可能是NaOH溶液
B. 若甲是Fe,則丁可能是Cl2
C. 若丁是CO2,則甲可能為Mg
D. 若丁是O2,則乙、丙的相對分子質量可能相差16
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】據不完全統計,全世界每年約有10%~20%的農副產品,水產品會因腐敗變質而無法食用,經濟損失巨大,所以研究安全無害的食品防腐劑很重要,山梨酸及其鹽,尼泊金酯等可作為食品防腐劑,其結構簡式如圖:
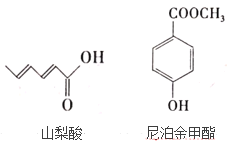
按要求回答下列問題:
(1)寫出山梨酸中含氧官能團的名稱___。
(2)常溫下,等物質的量的山梨酸、尼泊金甲酯分別與足量溴水反應,消耗Br2的物質的量之比為___。
(3)寫出尼泊金甲酯與NaOH溶液反應的化學方程式____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z為元素周期表中原子序數依次增大的三種短周期元素,Y與X、Z均相鄰,X、Y與Z三種元素原子的最外層電子數之和為19;W的單質為生活中一種常見的金屬,在Z元素的單質中燃燒產生棕黃色的煙,生成![]() 。回答下列問題:
。回答下列問題:
(1)Z元素在元素周期表中的第____周期。
(2)![]() 與足量的
與足量的![]() 的水溶液發生反應生成兩種強酸,寫出該反應的離子方程式____。
的水溶液發生反應生成兩種強酸,寫出該反應的離子方程式____。
(3)![]() 易升華,易溶于水,乙醇/丙酮等溶劑。據此推測其晶體熔化時克服的作用力是__,判斷的依據是____。
易升華,易溶于水,乙醇/丙酮等溶劑。據此推測其晶體熔化時克服的作用力是__,判斷的依據是____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)實驗室用金屬銅和稀硝酸制取NO的離子方程式為______________________。
(2)NO是有毒氣體,某學生為防止污染,用分液漏斗和燒杯裝配了一套簡易的、能隨開隨用、隨關隨停的NO氣體發生裝置,如圖甲所示。

①實驗室若沒有銅絲,而只有小銅粒,在使用上述裝置進行實驗時,可用絲狀材料包裹銅粒以代替銅絲進行實驗,這種絲狀材料的成分可以是________(填序號)。
A.鐵 B.鋁 C.鉑 D.玻璃
②打開分液漏斗的活塞使反應進行,在分液漏斗中實際看到的氣體是紅棕色的,原因是__________(填化學方程式)。
(3)為證明銅絲與稀硝酸反應生成的確實是NO,某學生另設計了一套如圖乙所示的裝置制取NO。反應開始后,可以在U形管右端觀察到無色的NO氣體。
①長玻璃管的作用是______________________________________________________。
②讓反應停止的操作方法及原因是__________________________________________。
(4)以下收集NO氣體的裝置,合理的是________(填序號)。
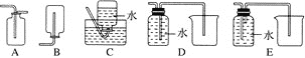
(5)將32.64 g銅與140 mL一定濃度的硝酸反應,銅完全溶解產生的NO和NO2混合氣體在標準狀況下的體積為11.2 L。請回答:
①NO的體積為________ L,NO2的體積為________ L。
②待產生的氣體全部釋放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部轉化成沉淀,則原硝酸溶液的濃度為________ mol·L-1。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】水的離子積常數Kw與溫度T(℃)的關系如圖D3-5所示:
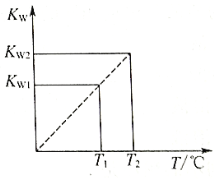
(1)若T1=25℃,則Kw1=_____________;若T2=100℃時,Kw2=10-12,則此時0.05mol/L的Ba(OH)2溶液的pH=_____________。
(2)已知25℃時,0.1L 0.1mol/L的NaA溶液的pH=10,則NaA溶液中存在的平衡有_______________________________________________。
溶液中各離子的物質的量濃度由大到小的順序為__________________________。
(3)25℃時,將pH=11的NaOH溶液與pH=4的硫酸溶液混合,若所得混合溶液的pH=9,則NaOH溶液與硫酸溶液的體積比為_____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com