
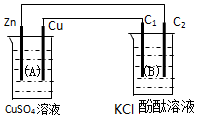
 按如圖裝置進行實驗,圖中C1、C2均為石墨棒.請回答下列問題.
按如圖裝置進行實驗,圖中C1、C2均為石墨棒.請回答下列問題.分析 該裝置A中有自發進行的氧化還原反應為原電池,鋅易失電子作負極,銅作正極,B為電解池,B中連接銅的電極為陽極,連接鋅的電極為陰極,電解池中陽極上氯離子放電,陰極上氫離子放電,根據串聯電路中得失電子守恒計算.
解答 解:(1)A中有自發進行的氧化還原反應,能將化學能轉化為電能,活潑性較強的Zn為負極,電極反應式為Zn-2e-=Zn2+;活潑性較弱的Cu為正極,石墨棒C1與正極相連為陽極,陽極上氯離子失電子生成氯氣,其電極反應式為:2Cl--2e-=Cl2↑;石墨棒C2為陰極,陰極上電解水生成氫氣和氫氧根離子,所以陰極附近有氣泡,溶液變紅,
故答案為:負;Zn-2e-=Zn2+;陽;2Cl--2e-=Cl2↑;有氣泡,溶液變紅;
(2)石墨棒C2為陰極,陰極上電解水生成氫氣和氫氧根離子,其電極方程式為:4H2O+4e-=2H2↑+4OH-,當C2極析出224mL氣體(標準狀態)時,生成氫氣的物質的量為n(H2)=$\frac{0.224L}{22.4L/mol}$=0.01mol,則轉移的電子為0.02mol,Zn電極的方程式為:Zn-2e-=Zn2+,根據電子守恒可知,消耗的Zn為0.01mol,則鋅的質量減少0.65g;根據A中電池反應式Zn+Cu2+=Cu+Zn2+,故生成銅單質是0.01mol,質量是0.64g,CuSO4溶液的質量增加了0.65g-0.64g=0.01g,
故答案為:0.65;增大;0.01.
點評 本題考查了原電池和電解池原理,正確判斷原電池和電解池的電極反應是解本題關鍵,難點是電極反應式的書寫和電子守恒的應用,難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 等量的硫蒸氣和硫固體在氧氣中分別完全燃燒,放出熱量一樣多 | |
| B. | 需要加熱才能發生的反應一定是吸熱反應 | |
| C. | 在101kpa時,2gH2完全燃燒,生成液態水,放出285.8kJ熱量,則氫氣燃燒的熱化學方程式表示為:2H2(g)+O2(g)═2H2O(l)△H=-285.8kJ/mol | |
| D. | 在強酸強堿稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,若將含1molNaOH的溶液和含0.5molH2SO4的濃硫酸混合,放出的熱量大于57.3 kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| Fe2+ | Fe3+ | Cu2+ | |
| 開始沉淀時pH | |||
| 完全沉淀時pH | 8 | 3.2 | 6.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 我們的祖先很早就學會了燒制陶瓷、冶煉金屬、釀造酒類 | |
| B. | 化學研究的主要目的是認識分子 | |
| C. | 化學科學無法幫助研究人員了解疾病的病理 | |
| D. | 意大利化學家阿伏伽德羅提出了原子學說,為近代化學的發展奠定了基礎 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ① | B. | ②③④ | C. | ①②④ | D. | ①②⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 由水電離產生的c(H+)=1×10-12 mol•L-1的溶液中:K+、Na+、Fe2+、NO3- | |
| B. | 室溫下,pH=7的溶液中:Al3+、Cl-、HCO3-、SO42- | |
| C. | 加酚酞呈紅色的溶液中:CO32-、Cl-、F-、NH4+ | |
| D. | c(H+)/c(OH-)=1012的溶液中:NH4+、NO3-、Cl-、Fe3+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 200mL2mol/LMgCl2溶液 | B. | 1000mL2.5mol/LNaCl溶液 | ||
| C. | 300mL5mol/LFeCl3溶液 | D. | 250mL lmol/L AlCl3溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 甲醇是一種可再生能源,具有廣泛的開發和應用前景.工業上一般可采用如下反應來合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-a kJ/mol. 在T℃時,往一個體積固定為1L的密閉容器中加入1mol CO和2mol H2,反應達到平衡時,容器內的壓強是開始時的3/5.
甲醇是一種可再生能源,具有廣泛的開發和應用前景.工業上一般可采用如下反應來合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-a kJ/mol. 在T℃時,往一個體積固定為1L的密閉容器中加入1mol CO和2mol H2,反應達到平衡時,容器內的壓強是開始時的3/5.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com