
【題目】磷化硼(BP)是一種受到高度關注的金屬保護層耐磨材料,可由三溴化硼和三溴化磷在氫氣中高溫制得。
(1)合成BP的反應中,基態原子未成對電子最多的元素符號為____,核外電子數最多的元素的基態原子電子占據最高能級上的電子數為____。B所在的周期第一電離能最大的元素名稱為____。
(2)三溴化磷分子的中心原子價層電子對數為____,分子空間結構為____形。BBr3空間結構為____形,PBr3分子中鍵角比BBr3分子中鍵角____(填>、<或=)。
(3)N與P同主族。科學家在一定條件下把氮氣(氮氮三鍵鍵能為942kJmol-1)聚合為固體高聚氮,全部以N-N鍵相連且鍵能為160kJmol-1,這種固體高聚氮可能潛在的用途是____,這是因為____。
(4)BP晶胞,磷原子在晶胞中采用金屬銅原子的堆積方式,硼原子填充在其四面體空隙中,則其四面體填充率為____,已知晶胞參數a=478pm,則硼和磷原子的核間距為____pm(保留整數)。
【答案】P 5 氖 4 三角錐 平面三角形 < 炸藥(或高能材料) 固體高聚氮斷開2molN-N鍵,結合成氮分子,且斷裂2molN-N鍵消耗320kJ,生成1mol氮氮三鍵放出942kJ,因此這是個劇烈放熱且劇烈熵增(產生大量氣體)的反應。 50% 207
【解析】
(1)根據B、P、Br的核外電子排布式,判斷出基態原子未成對電子最多的元素、核外電子數最多的元素的基態原子電子占據最高能級上的電子數;
(2)結合ABn型分子的中心原子的價層電子對數=![]() 鍵數+孤電子對數,結合中心原子上的孤電子對數,判斷出ABn型分子的中心原子的雜化類型,以及分子空間構型;
鍵數+孤電子對數,結合中心原子上的孤電子對數,判斷出ABn型分子的中心原子的雜化類型,以及分子空間構型;
(3)結合舊鍵斷裂吸收能量,新鍵形成釋放能量,依據題中給的數據進行相關計算;
(4)金屬銅為面心立方堆積,面心立方晶胞中存在8個四面體空隙,結合BP的化學式,計算出B原子填隙率;根據硼和磷原子的核間距為晶胞體對角線的![]() ,結合晶胞參數,計算出體對角線。
,結合晶胞參數,計算出體對角線。
(1)基態B原子核外電子排布式1s22s22p1,基態P原子核外電子排布式為1s22s22p63s23p3,基態溴原子的核外電子排布式為[Ar]3d104s24p5,根據洪特規則,基態原子未成對電子最多的元素符號為P,核外電子數最多的元素是Br,占據最高能級上的電子數為5;B在元素周期表中位于第二周期,第二周期第一電離能最大的元素是Ne,其核外電子排布為全充滿結構;
(2)三溴化磷分子的中心原子價層電子對數=![]() 鍵數+孤電子對數,1個PBr3分子中含有3個
鍵數+孤電子對數,1個PBr3分子中含有3個![]() 鍵,中心P原子上的孤電子對數為1,故三溴化磷分子的中心原子價層電子對數為4,PBr3分子空間結構為三角錐形;BBr3分子的中心原子價層電子對數3,并且中心原子上不含孤電子對,故BBr3空間結構為平面三角形,PBr3分子中P原子的雜化方式為sp3雜化,BBr3分子中的B的雜化方式為sp2雜化,故PBr3分子中鍵角比BBr3分子中鍵角小;
鍵,中心P原子上的孤電子對數為1,故三溴化磷分子的中心原子價層電子對數為4,PBr3分子空間結構為三角錐形;BBr3分子的中心原子價層電子對數3,并且中心原子上不含孤電子對,故BBr3空間結構為平面三角形,PBr3分子中P原子的雜化方式為sp3雜化,BBr3分子中的B的雜化方式為sp2雜化,故PBr3分子中鍵角比BBr3分子中鍵角小;
(3)結合題中的數據信息,固體高聚氮斷開2molN-N鍵,結合成氮分子,且斷裂2molN-N鍵消耗320kJ,生成1mol氮氮三鍵放出942kJ,因此這是個劇烈放熱且劇烈熵增(產生大量氣體)的反應,故固體高聚氮可以用作炸藥(或高能材料);
(4)金屬銅為面心立方堆積,面心立方晶胞中存在8個四面體空隙,倘若被B原子全部填充,則不符合磷化硼的化學組成,據化學式BP可知B原子填隙率僅為50%,其晶胞結構如圖所示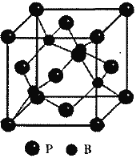 ,已知晶胞參數a=478pm,則晶胞的體對角線長為
,已知晶胞參數a=478pm,則晶胞的體對角線長為![]() ,晶胞中硼和磷原子的核間距為體對角線的
,晶胞中硼和磷原子的核間距為體對角線的![]() ,所以晶胞中硼和磷原子的核間距為
,所以晶胞中硼和磷原子的核間距為![]() 。
。


 考前必練系列答案
考前必練系列答案科目:高中化學 來源: 題型:
【題目】有A、B、C、D、E五種短周期元素,其中D與A、B、C均能形成原子個數比為1∶1與1∶2的兩類化合物X、Y,E的某種含氧酸或含氧酸鹽在一定條件下可分解生成D的單質。
(1)由上述條件可以確定的元素編號及對應元素名稱是____________,其中原子間通過共用一對電子而形成的單質的電子式為________________,E能形成多種含氧酸,其中酸性最強的含氧酸的分子式為______________。
(2)若所有可能的X、Y中,C、D形成的是離子化合物,其中一種物質中含有兩類化學鍵,那么另一種物質的形成過程用電子式可表示為______________________________________。
(3)若上述X、Y存在如下變化:X+Y→Z+D2,且X、Y中各原子(離子)最外層上均有8個電子,則該反應的化學方程式為__________________,反應物中存在非極性鍵的物質是__________,生成物中存在非極性鍵的物質是_____________,由此說明化學反應的本質是________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)比較金屬性的強弱:Na_________K(填“>”、“<”或“=”);反應Na+KClNaCl+K↑能發生的原因是________________。
(2)COCl2是共價化合物,各原子均滿足8電子穩定結構。寫出COCl2的結構式__________。
(3)電解熔融氧化鋁制備金屬鋁時,需要定期更換陽極石墨塊,理由是_________________(用化學反應方程式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳在冶金工業上具有重要用途。已知氧與碳的反應主要有:
Ⅰ.C(s)+O2(g)CO2(g) △H1=-394kJ·mol-1
Ⅱ.2C(s)+O2(g)2CO(g) △H2=-221kJ·mol-1
Ⅲ.2CO(g)+O2(g)2CO2(g) △H3
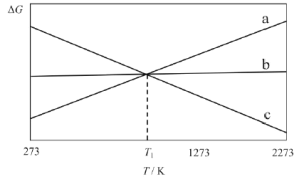
上述反應的△G~T如圖所示,且滿足△G=△H-T△S。
請回答:
(1)曲線a代表反應_________(填“I”、“II”或“III”),理由是__________。
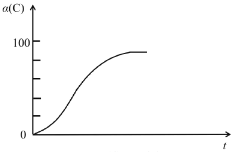
(2)研究發現,以CO2替代高溫水蒸氣作為煤氣化反應(H2O與C反應)的氣化劑,實現了CO2零排放的新工藝。寫出反應IV的熱化學方程式___________(碳的計量數為1)。在1273K時,測得碳轉化率[α(C)]與時間t變化如圖所示。保持其它條件不變,請畫出1773K時α(C)~t關系圖______。
(3)當T=T1時,反應IV處于平衡狀態,下列關于反應IV的說法正確的是_________。
A.因平衡時△G=0,若△H變化173.3kJ·mol-1,△S變化173.3J·K-1·mol-1,計算得T1=1000K
B.T<T1時,反應向逆反應方向移動
C.當碳的濃度不再變化時,一定處于平衡狀態
D.因平衡常數K的值不再變化,反應達到了平衡
(4)當T=1273K時,僅存在CO、CO2兩種氣體,且維持總壓為1 atm,此時反應IV的Kp=112,則CO氣體所占的分壓p(CO)為___________atm。(列式即可)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25 ℃時,用濃度為0.1000 mol·L-1的NaOH溶液滴定20.00 mL濃度均為0.1000 mol·L-1的三種酸HX、HY、HZ,滴定曲線如下圖所示。下列說法錯誤的是
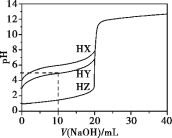
A.在相同溫度下,同濃度的三種酸溶液的導電能力順序:HX<HY<HZ
B.將上述HX、HY溶液等體積混合后,用NaOH溶液滴定至HX恰好完全反應時:c(X-)>c(Y-)>c(OH-)>c(H+)
C.根據滴定曲線,可得知Y-的水解常數K約為10-9
D.由圖象可知酸堿中和滴定分析不適用于極弱的酸和極弱的堿的測定
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下面是合成藥物格列衛的中間體J的一種合成路線:
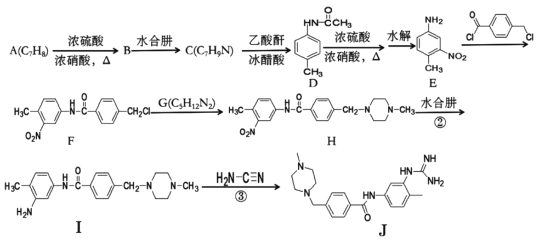
回答下列問題:
(1)A的名稱為____,B的化學式為____。
(2)F中含氧官能團名稱為____
(3)B→C和I→J的反應類型分別為____、____。
(4)G的結構簡式為____。
(5)芳香化合物X是D的同分異構體,苯環上具有三個取代基且氨基與苯環直接相連,X能發生銀鏡反應,分子結構只有一個乙基,符合條件的X的結構式有____種。
(6)寫出用甲苯、乙醇為原料制備對氨基苯甲酸乙酯的合成路線:_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于如下反應,其反應過程的能量變化示意圖如圖:
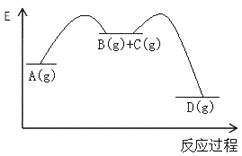
編號 | 反應 | 平衡常數 | 反應熱 |
反應① | A(g)=B(g)+C(g) | K1 | △H1 |
反應② | B(g)+C(g)=D(g) | K2 | △H2 |
反應③ | A(g)= D(g) | K3 | △H3 |
下列說法正確的是
A.K3 =K1 + K2B.△H3=△H1+△H2
C.加催化劑,反應①的反應熱降低,反應速率加快D.則增大壓強,K1減小,K2增大,K3不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用CO和H2在催化劑的作用下合成甲醇,發生的反應如下:CO(g)+2H2(g)![]() CH3OH(g),在體積一定的密閉容器中按物質的量之比1:2充入CO和H2,測得平衡混合物中CH3OH的體積分數在不同壓強下隨溫度的變化如圖所示。下列說法正確的是
CH3OH(g),在體積一定的密閉容器中按物質的量之比1:2充入CO和H2,測得平衡混合物中CH3OH的體積分數在不同壓強下隨溫度的變化如圖所示。下列說法正確的是

A. 該反應的△H<0,且p1<p2
B. 反應速率:ν逆(狀態A)>ν逆(狀態B)
C. 在C點時,CO轉化率為75%
D. 在恒溫恒壓條件下向密閉容器中充入不同量的CH3OH,達平衡時CH3OH的體積分數也不同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室通常用圖所示的裝置來制取氨氣。請按要求回答下列問題:
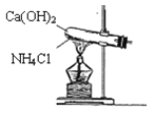
(1)實驗室制取氨氣的化學反應方程式為__。
(2)除了以上方法。下面也能用于制備氨氣的是___。
①固態氯化銨加熱分解
②濃氨水中加入固體氫氧化鈉
③加熱濃氨水
(3)NH3的催化氧化的化學反應方程式為__。
(4)①用裝置A收集氨氣時,應選擇氨氣的進氣口是___(選填“a”或“b”),并說明選擇的理由___。
②打開裝置A中的止水夾,若觀察到燒瓶內產生了紅色噴泉,則說明氨氣具有的性質是___、___。
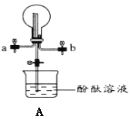
(5)通常可以用什么方法來檢驗無色溶液中是否有NH4+___。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com