
【題目】(1)化合物![]() 的相對分子質量為86,所含碳的質量分數為
的相對分子質量為86,所含碳的質量分數為![]() ,氫的質量分數為
,氫的質量分數為![]() ,其余為氧。
,其余為氧。
①![]() 的分子式為______。
的分子式為______。
②![]() 有多種同分異構體,寫出五個同時滿足下列條件的同分異構體的結構簡式:______、______、______、______、______。
有多種同分異構體,寫出五個同時滿足下列條件的同分異構體的結構簡式:______、______、______、______、______。
(i)含有酯基(ii)能使溴的四氯化碳溶液褪色
(2)烴基烯基醚(![]() )
)![]() 的相對分子質量為176,其分子中碳氫原子個數比為
的相對分子質量為176,其分子中碳氫原子個數比為![]() ,則
,則![]() 的分子式為______。
的分子式為______。
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】700℃時,向容積為2 L的密閉容器中充入一定量的CO和H2O,發生反應:CO(g)+H2O(g)![]() CO2(g)+H2(g),反應過程中測定的部分數據見下表(表中t2>t1):
CO2(g)+H2(g),反應過程中測定的部分數據見下表(表中t2>t1):
反應時間/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列說法正確的是
A. 反應在t1 min內的平均速率為v(H2)=![]() mol·L-1·min-1
mol·L-1·min-1
B. 保持其他條件不變,起始時向容器中充入0.60 mol CO和1.20 mol H2O,達到平衡時n(CO2)=0.40mol
C. 保持其他條件不變,向平衡體系中再通入0.20 mol H2O,與原平衡相比,達到新平衡時CO轉化率不變,H2O的體積分數不變
D. 溫度升高至800 ℃,上述反應平衡常數為0.64,則正反應為放熱反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】FeSO4溶液放置在空氣中容易變質,因此為了方便使用Fe2+,實驗室中常保存硫酸亞鐵銨晶體[俗稱“摩爾鹽”,化學式為(NH4)2Fe(SO4)26H2O],它比綠礬或綠礬溶液更穩定。
I.某興趣小組設計實驗制備硫酸亞鐵銨晶體。
本實驗中,配制溶液以及后續使用到的蒸餾水都經過煮沸、冷卻后再使用。向FeSO4溶液中加入飽和(NH4)2SO4溶液,經過操作_______、冷卻結晶、過濾、洗滌和干燥后得到一種淺藍綠色的晶體。
II.實驗探究影響溶液中Fe2+穩定性的因素
(1)配制0.8 mol/L的FeSO4溶液(pH=4.5)和0.8 mol/L的(NH4)2Fe(SO4)2溶液(pH=4.0),各取2 mL上述溶液于兩支試管中,剛開始兩種溶液都是淺綠色,分別同時滴加2滴0.01mol/L的KSCN溶液,15min后觀察可見:(NH4)2Fe(SO4)2溶液仍然為淺綠色透明澄清溶液,FeSO4溶液則出現淡黃色渾濁。
(資料1)
沉淀 | Fe(OH)2 | Fe(OH)3 |
開始沉淀 pH | 7.6 | 2.7 |
完全沉淀 pH | 9.6 | 3.7 |
①請用離子方程式解釋FeSO4溶液產生淡黃色渾濁的原因___________________。
②討論影響Fe2+穩定性的因素,小組同學提出以下3種假設:
假設1:其他條件相同時,NH4+的存在使(NH4)2Fe(SO4)2溶液中Fe2+穩定性較好。
假設2:其他條件相同時,在一定 pH范圍內,溶液 pH越小Fe2+穩定性越好。
假設3:__________________________________________________。
(2)小組同學用如圖裝置(G為靈敏電流計),滴入適量的硫酸溶液分別控制溶液A(0.2 mol/L NaCl)和溶液B(0.1mol/L FeSO4)為不同的 pH,觀察記錄電流計讀數,對假設2進行實驗研究,實驗結果如下表所示。
序號 | A 0.2mol/LNaCl | B 0.1mol/LFeSO4 | 電流計讀數 |
實驗1 | pH=1 | pH=5 | 8.4 |
實驗2 | pH=1 | pH=1 | 6.5 |
實驗3 | pH=6 | pH=5 | 7.8 |
實驗4 | pH=6 | pH=1 | 5.5 |
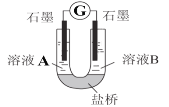
(資料2)原電池裝置中,其他條件相同時,負極反應物的還原性越強或正極反應物的氧化性越強,該原電池的電流越大。
(資料3)常溫下,0.1mol/LpH=1的FeSO4溶液比pH=5的FeSO4溶液穩定性更好。
根據以上實驗結果和資料信息,經小組討論可以得出以下結論:
①U型管中左池的電極反應式_________________。
②對比實驗1和2(或3和4),在一定pH范圍內,可得出的結論為______ 。
③對比實驗_____和_____ 還可得出在一定 pH范圍內,溶液酸堿性變化是對O2氧化性強弱的影響因素。
④對(資料3)實驗事實的解釋為____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】聚苯乙烯的結構簡式為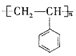 ,試回答下列問題:
,試回答下列問題:
(1)聚苯乙烯的分子式為__________,鏈節是____________,單體是_________________。
(2)實驗測得聚苯乙烯的相對分子質量(平均值)為52000,則該高聚物的聚合度![]() 為________。
為________。
(3)一定條件下合成聚苯乙烯的化學方程式為______,該反應類型為_______反應。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從某中草藥提取的有機物結構如圖所示,該有機物的下列說法中錯誤的是( )
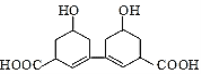
A.分子式為C14H18O6
B.1mol該有機物最多可與2mol的H2發生加成反應
C.既可以與FeCl3溶液發生顯色反應,又可以與Na2CO3溶液反應
D.1mol該有機物最多可反應2mol氫氧化鈉
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與生活密切相關,下列說法不正確的是( )
A.用來制造電線電纜的聚乙烯樹脂屬于熱塑性高分子材料
B.研發可降解高分子材料,可以減少“白色污染”
C.棉、麻、羊毛及合成纖維完全燃燒都只生成![]() 和
和![]()
D.硅橡膠![]() 可由
可由![]() 經水解、縮聚兩步反應制得
經水解、縮聚兩步反應制得
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】烴分子中若含有雙鍵、叁鍵或環,其碳原子所結合的氫原子則少于同碳原子數對應烷烴所含的氫原子數,亦具有一定的不飽和度![]() 用
用![]() 表示
表示![]() 。下表列出幾種烴的不飽和度:
。下表列出幾種烴的不飽和度:
有機物 | 乙烯 | 乙炔 | 環己烷 | 苯 |
| 1 | 2 | 1 | 4 |
據此下列說法不正確的是![]()
![]()
A.![]() 的不飽和鏈烴再結合6molH即達到飽和
的不飽和鏈烴再結合6molH即達到飽和
B.![]() 的
的![]() 等于6
等于6
C.![]() 與環丁烷的不飽和度相同
與環丁烷的不飽和度相同
D.![]() 的不飽和度與
的不飽和度與![]() 、
、![]() 的不飽和度相同
的不飽和度相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】SPC(2Na2CO33H2O2)具有Na2CO3和H2O2的雙重性質,廣泛應用于印染、醫藥衛生等領域。以芒硝(Na2SO410H2O)、H2O2等為原料制備SPC的工藝流程如下:
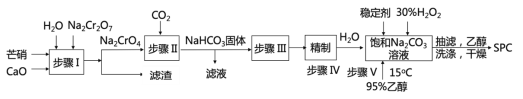
回答下列問題:
(1)步驟I產生的濾渣為__________________(填名稱)。
(2)步驟II中發生反應的離子方程式為_________________。其中生成的__________(填化學式)可以循環使用。
(3)步驟V中,合成時需選擇溫度為15℃,其原因是_____________________。
(4)抽濾后用乙醇洗滌的作用是_______________________________________。
(5)SPC的保存方法是______________________________。
(6)過氧化氫用催化劑催化分解時生成水和氧原子,該氧原子非常活潑,稱為活性氧。稱量0.1600 g樣品,置于250 mL錐形瓶中,并用100 mL 0.5 molL-1硫酸溶解完全,立即用0.02000molL-1KMnO4標準溶液滴定,滴定至終點時溶液顏色為_____,且半分鐘內不恢復為原來的顏色,進行三次平行實驗,消耗KMnO4溶液的平均體積為26.56 mL。另外,在不加樣品的情況下按照上述過程進行空白實驗,消耗KMnO4溶液的平均體積為2.24 mL。該樣品的活性氧含量為______%。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A.燃燒熱的數值都會隨反應物的用量不同而改變,故1mol S(s)和2mol S(s)的燃燒熱不相等
B.已知:2C(s)+2O2(g)=2CO2(g)ΔH=akJ/mol;2C(s)+2O2(g)=2CO(g)ΔH=bkJ/mol 則a>b
C.H2(g)的燃燒熱為285.8kJ/mol,則表示H2燃燒熱的熱化學方程式為:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ/mol
D.反應NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) ΔH=+185.57kJ/mol,在低溫條件下不能自發進行,但在高溫條件下能自發進行
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com