
分析 (1)碘化鉀和碘酸鉀在酸性條件下能發生氧化還原反應生成碘,碘遇淀粉變藍色,據此分析;
(2)IO3-+5I-+6H+═3I2+3H2O根據此反應方程式知,該反應需要酸性條件,需要碘離子,需要淀粉碘化鉀試紙檢驗,據此判斷選項;
解答 解:(1)碘化鉀和碘酸鉀在酸性條件下能發生氧化還原反應生成碘5KI+KIO3+6HCl=6KCl+3H2O+3I2;
該反應中KI是還原劑,還原劑對應的產物是氧化產物,KIO3是氧化劑,氧化劑對應的產物是還原產物,所以氧化產物、還原產物都是碘,物質的量之比為 5:1;
該反應中有碘單質生成,碘遇淀粉變藍色,所以觀察到溶液變藍色.
故答案為:5KI+KIO3+6HCl=6KCl+3H2O+3I2; 5:1; 溶液變藍色.
依題意:IO3-+5I-+6H+=3I2+3H2O;結合I2的特性----遇淀粉變藍,要檢驗食鹽中存在IO3-,
只需I-和酸溶液(即H+),生成的I2由淀粉檢驗,故選B.
點評 本題考查了物質的檢驗,氧化還原反應的概念分析,電子轉移的計算應用,難度不大,會根據題中信息及物質的特殊性質選取試劑.


科目:高中化學 來源: 題型:解答題
 甲醇是一種可再生能源,具有開發和應用的廣闊前景,請回答下列問題
甲醇是一種可再生能源,具有開發和應用的廣闊前景,請回答下列問題查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 氫氧化鈉溶液與鹽酸反應:OH-+H+═H2O | |
| B. | H2SO4溶液中滴入Ba(OH)2溶液:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | 氧化鎂與稀鹽酸混合:MgO+2H+═Mg2++H2O | |
| D. | 氫氧化鋇溶液與硫酸銅溶液反應:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 只有① | B. | ①③⑤ | C. | ②④⑤⑥ | D. | ①③ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
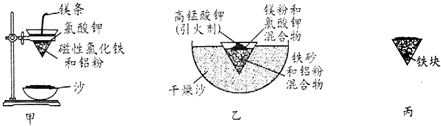
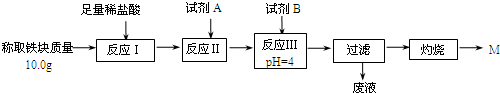
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 開始沉淀時的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全時的pH | 9.0 | 4.0 | 5 | 11 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Al2O3用作耐火材料、Al(OH)3用作阻燃劑 | |
| B. | 用苯萃取溴水中的溴時,將溴的苯溶液從分液漏斗下口放出 | |
| C. | 碳素鋼的主要成分是鐵碳合金、司母戊鼎的主要成分是銅錫合金 | |
| D. | 盛放NaOH溶液的磨口玻璃瓶要用橡膠塞 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
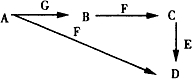 A~G為中學化學中常見的物質,B、E、F為單質,在常溫下B是一種有色氣體,G為黑色的固體.它們的相互轉化如圖所示,部分生成物未列出.試回答下列問題
A~G為中學化學中常見的物質,B、E、F為單質,在常溫下B是一種有色氣體,G為黑色的固體.它們的相互轉化如圖所示,部分生成物未列出.試回答下列問題查看答案和解析>>
科目:高中化學 來源: 題型:解答題
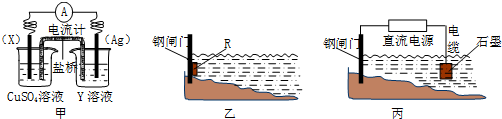
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com