
【題目】下列離子方程式正確的是( )
A.硅酸鈉溶液與鹽酸反應![]() +2HCl=2Cl-+ H2O+SiO2↓
+2HCl=2Cl-+ H2O+SiO2↓
B.水玻璃中通入過量二氧化碳![]() +CO2+H2O=
+CO2+H2O=![]() +H2SiO3↓
+H2SiO3↓
C.硅酸與氫氧化鈉溶液反應H2SiO3+ OH-=![]() + H2O
+ H2O
D.SiO2與氫氧化鈉溶液反應SiO2+2OH-=![]() +H2O
+H2O
【答案】D
【解析】
A.硅酸鈉溶液與鹽酸反應生成氯化鈉和硅酸,鹽酸為強酸,應寫離子形式,硅酸沉淀應寫化學式,正確的離子方程式為:SiO32-+2H+=H2SiO3↓,故A不符合題意;
B.在硅酸鈉溶液中通入過量的二氧化碳生成硅酸和碳酸氫鈉,正確的離子方程式為:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-,故B不符合題意;
C.硅酸和氫氧化鈉溶液反應生成硅酸鈉和水,電荷不守恒,正確的離子方程式為:H2SiO3+2OH-=SiO32-+2H2O,故C不符合題意;
D.二氧化硅和氫氧化鈉溶液反應生成硅酸鈉和水,離子方程式:SiO2+2OH-=SiO32-+H2O,故D符合題意;
綜上,本題選D。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】厭氧氨化法(Anammox)是一種新型的氨氮去除技術,下列說法中正確的是
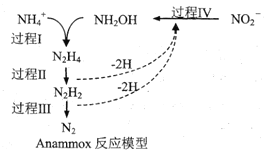
A.1molNH4+所含的質子總數為10NA(設NA為阿伏加德羅常數的值)
B.該方法每處理1molNH4+,需要0.5molNO2-
C.過程IV中,NO2-發生氧化反應
D.N2H2中含有σ鍵和π鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某實驗室模擬以粗鹽(含雜質Mg2+、Ca2+、K+和SO42-)為原料進行生產并綜合利用的某過程如下圖所示。已知: Kap[Mg(OH)2]=5.6×10-12;Kap[CaMg(CO3)2]<< Kap[Mg(OH)2]。

(1)過量試劑A是_________________________溶液。(填名稱)
(2)圖為KCI和NaCl的溶解度曲線,連續操作④是_____________________________。

(3)向濾液IV中通入NH3CO2氣體后能夠得到NaHCO3的原因是_______________(用必要的化學用語和文字說明)。
(4)已知碳酸的Ka2=5.6×10-11,次氯酸的Ka =3×10-8,工業上用飽和純堿溶液代替燒堿溶液與Cl2反應生產有效成分為次氯酸鈉的消毒液,反應的化學方程式是___________________________________。
(5)經檢測,濾液Ⅲ中c(Mg2+)<1.0×10-7 mol/L,則鎂元素最終沉淀物是_________________。
(6)⑤處母液可以生產氮肥NH4Cl,NH4Cl可用于制取具有漂白作用的三氯化氮。工業上制備NCl3的一種方法是用圖所示裝置電解,其原理是NH4Cl+2HCl![]() NC13十3H2↑。
NC13十3H2↑。

陽極反應式是___________________________________。
(7)電解氯化鈉時需要加入一定量氯化鈣,根據學習過的電解知識推測加入氯化鈣的主要作用是_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知A為淡黃色固體,R是地殼中含量最多的金屬元素的單質,T為生活中使用最廣泛的金屬單質,D是具有磁性的黑色晶體,C、F是無色無味的氣體,H是白色沉淀,W溶液中滴加KSCN溶液出現血紅色。

(1)物質A的化學式為___,F化學式為___;
(2)B和R在溶液中反應生成F的離子方程式為___;
(3)H在潮濕空氣中變成M的實驗現象是___,化學方程式為___。
(4)A和水反應生成B和C的離子方程式為___,由此反應可知A有作為___的用途。
(5)M投入鹽酸中的離子方程式___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲醇水蒸氣催化重整反應是生產氫能的有效方法之一。
(1)甲醇水蒸氣重整制氫存在以下副反應:(已知a、b均大于零)
Ⅰ:甲醇分解 :CH3OH(g) CO(g)+2H2(g) △H= +akJ·mol-1
Ⅱ:水蒸氣變換:CO(g)+H2O(g)CO2(g)+ H2(g) △H= ![]() kJ·mol-1
kJ·mol-1
催化重整反應:CH3OH(g) +H2O(g)CO2(g)+ 3H2(g) △H=________kJ·mol-1
(2)甲醇分解與水蒸氣變換反應Kp與溫度關系見下表:
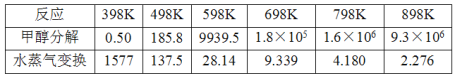
①698K時.CH3OH(g) +H2O(g)CO2(g)+ 3H2(g)的Kp=___________。(保留小數點后二位)
②在較高溫度下進行該反應.發現平衡時體系中CO含量偏高的原因是_____________。
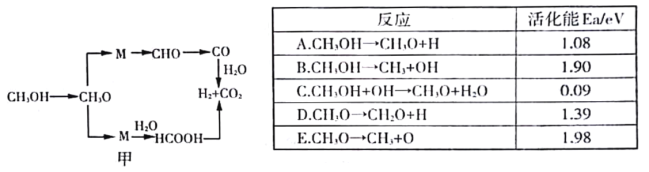
(3)甲醇水蒸氣重整反應的可能機理如圖甲所示.結合下表分析CH3OH →CH3O的主要反應為______________(填序號),解釋原因______________________________________________________________。
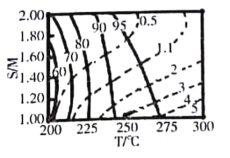
(4)某研究小組對重整反應溫度(T)與水醇比(![]() )進行優化,得到圖乙、丙。
)進行優化,得到圖乙、丙。
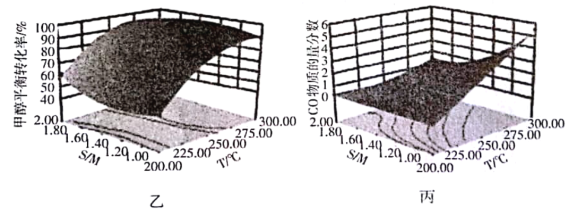
結合圖乙分析溫度、水醇比與甲醇平衡轉化率的關系:________________.
②在圖中用陰影畫出最優化的反應條件區域(下圖為乙和丙組合的平面圖,實線為甲醇平衡轉化率,虛線為CO物質的量分數):______________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某課外活動小組欲利用CuO與NH3反應,研究NH3的某種性質并測定其組成,設計了如下實驗裝置(夾持裝置未畫出)進行實驗。請回答下列問題:

(1)儀器a的名稱為______;儀器b中可選擇的試劑為______。
(2)實驗室中,利用裝置A,還可制取的無色氣體是______(填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)實驗中觀察到裝置C中黑色CuO粉末變為紅色固體,量氣管有無色無味的氣體,上述現象證明NH3具有______性,寫出相應的化學方程式______。
(4)E裝置中濃硫酸的作用______。
(5)讀取氣體體積前,應對裝置F進行的操作:______。
(6)實驗完畢,若測得干燥管D增重mg,裝置F測得氣體的體積為n L(已折算成標準狀況),則氨分子中氮、氫的原子個數比為______(用含m、n字母的代數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖是由常見元素組成的一些單質及其化合物之間的轉化關系圖。各方框表示有關的一種反應物或生成物(部分物質已經略去)。其中A、B、D在常溫下均為無色無味的氣體,C是能使濕潤的紅色石蕊試紙變藍的氣體,M是最常見的無色液體。

(1)寫出C→E的化學方程式: 。
(2)實驗室常用加熱兩種固體混合物的方法制備物質C,其化學方程式為: ,干燥C常用 (填寫試劑名稱)。
(3)E物質遇到D物質時,會觀察到 現象,若用排水法收集F,則最終集氣瓶中收集到的氣體為 (填寫物質的化學式)。
(4)寫出A→D的化學方程式: 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用惰性電極電解硫酸銅溶液,整個過程轉移電子的物質的量與產生氣體總體積的關系如圖所示(氣體體積均在相同狀況下測定)。欲使溶液恢復到起始狀態,可向溶液中加入( )

A.0.1 mol CuOB.0.1 mol CuCO3
C.0.1 mol Cu(OH)2D.0.05 mol Cu2(OH)2CO3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】KMnO4(s)受熱分解制備氧氣是實驗室制氧氣的常用方法,它也是一種高效氧化劑,是氧化還原滴定實驗中常用的試劑,可以作為標準溶液滴定一些具有還原性的物質(Fe2+、C2O42-等)的溶液,如5C2O42-+2MnO4-+l6H++4H2O=2[Mn(H2O)6]2++10CO2↑。
(1)基態Mn2+的核外電排布式為___。
(2)如果在空氣中焙燒KMnO4,可獲得Mn3O4(可改寫為MnOMn2O3),則Mn3O4中Mn的化合價為___。
(3)石墨烯(如圖A)是一種由碳原子組成六邊形呈蜂巢晶格的二維碳納米材料,當石墨烯中部分碳原子被氧化后,其平面結構會發生改變,轉化為氧化石墨烯(如圖B)。
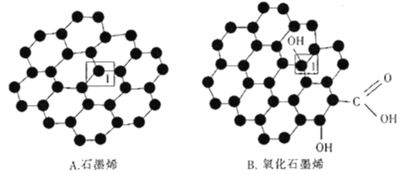
石墨烯結構中1號C的雜化方式為___;該C與相鄰的兩個C形成的鍵角___(填“>”“<”“=”)l20。氧化石墨烯結構中1號C與相鄰C___(填“有”或“沒有”)形成π鍵。
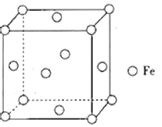
(4)鐵形成的晶體類型因為鐵原子排列方式的不同而不同,其中一種晶胞結構如圖所示。晶體中鐵原子周圍距離最近且等距的鐵原子數為___。形成鐵碳合金時,存在一種碳原子插入到晶胞中每條棱的中點和晶胞的體心的結構,該物質的化學式為___;設NA為阿伏加德羅常數的值,該鐵碳晶胞的晶胞參數為apm,則C原子間的最短距離為______pm,該鐵碳晶胞的密度為___ gcm-3。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com