
向一體積不變的密閉容器中加入2 mol A、0.6 mol C和一定量的B三種氣體.一定條件下發生反應,各物質濃度隨時間變化如圖一所示.圖二為t2時刻后改變反應條件,平衡體系中反應速率隨時間變化的情況,且四個階段都各改變一種不同的條件.已知t3~t4階段使用了催化劑;圖一中t0~t1階段c(B)未畫出.
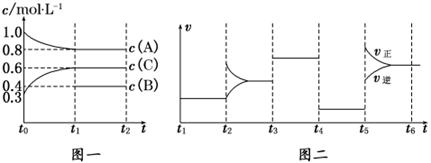
(1)若t1=15 min,則t0~t1階段以C濃度變化表示的反應速率為v(C)=_______________.
(2)t4~t5階段改變的條件為_______________,B的起始物質的量為_______________.
各階段平衡時對應的平衡常數如下表所示:
|
t1~t2 |
t2~t3 |
t3~t4 |
t4~t5 |
t5~t6 |
|
K1 |
K2 |
K3 |
K4 |
K5 |
則K1=_______________ (保留兩位小數),K1、K2、K3、K4、K5之間的關系為____ (用“>”、“<”或“=”連接).
(1)0.02 mol/(L·min) (2)減小壓強 1.0 mol 0.84 K1=K2=K3=K4<K5
【解析】
試題分析:(1)t1=15 min,C的濃度增加了0.6mol/L-0.3mol/L=0.3mol/L,注意t0~t1階段以C濃度變化表示的反應速率為v(C)=0.3mol/L÷15min=0.02 mol/(L·min)。
(2)根據圖像2可知,在t4~t5和t3~t4階段,反應速率均同時增大或同時減小,但平衡都不移動。階段在可知,四個階段都各改變一種不同的條件,這說明反應前后該反應一定是體積不變的可逆反應。根據圖像1可知,平衡時A減少了0.2mol/L,所以根據濃度的變化量之比是相應的化學計量數之比可知,B一定是反應物,且B的濃度減少了0.1mol/L,即該反應的方程式是2A+B 3C。所以起始時B的濃度是0.5mol/L。容器的體積是2mol÷1mol/L=2L,所以B物質的起始物質的量是1mol。t4~t5階段改變的條件為降低壓強。
3C。所以起始時B的濃度是0.5mol/L。容器的體積是2mol÷1mol/L=2L,所以B物質的起始物質的量是1mol。t4~t5階段改變的條件為降低壓強。
(3)根據圖像1可知,K1=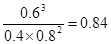 。根據圖像2可知,t5時改變的條件是升高溫度,正反應速率大于逆反應速率,即正方應是吸熱反應,所以平衡常數增大,則K1、K2、K3、K4、K5之間的關系為K1=K2=K3=K4<K5。
。根據圖像2可知,t5時改變的條件是升高溫度,正反應速率大于逆反應速率,即正方應是吸熱反應,所以平衡常數增大,則K1、K2、K3、K4、K5之間的關系為K1=K2=K3=K4<K5。
考點:考查反應速率、平衡常數的有關計算以及外界條件對平衡狀態的影響
點評:該題是中等難度的試題,試題基礎性強,側重對學生基礎知識的鞏固和訓練。該題的關鍵是明確反應速率和平衡常數的含義以及影響因素,然后圖像和方程式靈活運用即可。有利于培養學生的邏輯推理能力,提高學生分析、歸納、總結問題的能力。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:閱讀理解

查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| 實驗組 | 溫度/℃ | 起始量/mol | 平衡量/mol | 達到平衡所需時間/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化學 來源: 題型:
 碘鎢燈具有使用壽命長、節能環保等優點.一定溫度下,在碘鎢燈燈泡內封存的少量碘與沉積在燈泡壁上的鎢可以發生如下的可逆反應:
碘鎢燈具有使用壽命長、節能環保等優點.一定溫度下,在碘鎢燈燈泡內封存的少量碘與沉積在燈泡壁上的鎢可以發生如下的可逆反應:查看答案和解析>>
科目:高中化學 來源: 題型:
(10分)碘鎢燈具有使用壽命長、節能環保等優點。一定溫度下,在碘鎢燈燈泡內封存的少量碘與沉積在燈泡壁上的鎢可以發生如下的可逆反應:
W(s)+ I2(g) WI2(g)ΔH<0
為模擬上述反應,在450℃時向一體積為2L的恒容密閉容器中加入0.1mol碘單質和足量的鎢,2min后反應達到平衡,測得碘蒸氣濃度為0.005 mol·L-1。請回答下列問題:
(1)前兩分鐘內碘蒸氣的反應速率為 ▲ 。
(2)能夠說明上述反應已經達到平衡狀態的有 ▲ 。
A.I2與WI2的濃度相等
B.容器內氣體壓強不再變化
C.W的質量不再變化
D.單位時間內,金屬鎢消耗的物質的量與碘化鎢生成的物質的量相等
E.容器內混合氣體的密度保持不變
(3)下圖為該反應在450℃時的時間—速率圖,則t2時刻改變的外界條件可能是 ▲ ,若t4時刻將容器壓縮至一半(各物質狀態不變),保持該條件至t6,請在圖中畫出t4到t6時間段內大致曲線圖,并在相應曲線上標上υ3(正)、υ3(逆)
t0 t1 t2 t3 t4 t5 t6 t
(4)假設燈絲溫度為660℃,燈泡壁溫度為350℃。請根據化學反應原理分析在燈泡內充入碘能夠延長鎢絲壽命的原因 ▲ 。
查看答案和解析>>
科目:高中化學 來源:2012-2013學年山東省日照市高三第一次模擬考試理綜化學試卷(解析版) 題型:填空題
人工固氮是指將氮元素由游離態轉化為化合態的過程。
I.最近一些科學家研究采用高質子導電性的SCY陶瓷(能傳遞H+)實驗氮的固定一電解法合成氨,大大提高了氮氣和氫氣的轉化率。總反應式為:N2(g)+3H2(g)  2NH3(g),則在電解法合成氨的過程中,應將H2不斷地通入_________極(填“陰”或“陽”) ;向另一電極通入N2,該電極的反應式為__________________________。
2NH3(g),則在電解法合成氨的過程中,應將H2不斷地通入_________極(填“陰”或“陽”) ;向另一電極通入N2,該電極的反應式為__________________________。
II.據報道,在一定條件下,N2在摻有少量氧化鐵的二氧化鈦催化劑表面能與水發生反應,主要產物為NH3,相應的反應方程式為:2N2(g)+6H2O(g) 4NH3(g)+3O2(g) △H=Q。
4NH3(g)+3O2(g) △H=Q。
(1)上述反應的平衡常數表達式為_______________。
(2)取五份等體積N2和H2O的混合氣體(物質的量之比均為1:3),分別加入體積相同的恒容密閉容器中,在溫度不相同的情況下發生反應,反應相同時間后,測得氮氣的體積分數 與反應溫度T的關系曲線如圖所示,則上述反應的Q________0(填“>”、“<”或“=”)。
與反應溫度T的關系曲線如圖所示,則上述反應的Q________0(填“>”、“<”或“=”)。

(3)若上述反應在有催化劑的情況下發生,則下圖所示的a、b、c、d四條曲線中,能表示反應體系能量變化的是_______(選填字母代號),圖中△H的絕對值為1530kJ·mol-1。

III.目前工業合成氨的原理是:N2(g)+3H2(g)  2NH3(g) △H=-93.0kJ/mol。
2NH3(g) △H=-93.0kJ/mol。
回答下列問題:
(1)結合II中的數據,則O2(g)+2H2(g)=2H2O(g)的△H=______________。
(2)在一定溫度下,將1molN2和3mol H2混合置于體積不變的密閉容器中發生反應,達到平衡狀態時,測得氣體總物質的量為2.8mol。
①達平衡時,H2的轉化率α1=______________。
②在相同條件下,若起始時只將NH3置于該容器中,達到平衡狀態時NH3的轉化率為α2,當α1+α2=1時,則起始時NH3的物質的量n(NH3)=_____________mol。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com