
【題目】I. 某實驗小組對H2O2的分解做了如下探究。下表是研究影響H2O2分解速率的因素時記錄的一組數據,將質量相同但狀態不同的MnO2分別加入盛有15 mL5%的H2O2溶液的大試管中,并用帶火星的木條測試,結果如下:
MnO2 | 觸摸試管情況 | 觀察結果 | 反應完成所需的時間 |
粉末狀 | 很燙 | 劇烈反應,帶火星的木條復燃 | 3.5 min |
塊狀 | 微熱 | 反應較慢,火星紅亮,但木條未復燃 | 30 min |
(1)該反應是_________反應(填“放熱”或“吸熱”)。
(2)實驗結果表明,催化劑的催化效果與_____________有關。
Ⅱ.某可逆反應在體積為5 L的密閉容器中進行,0~3分鐘內各物質的物質的量變化情況如圖所示(A、B、C均為氣體)。
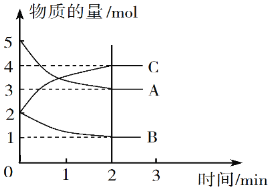
(3)該反應的化學方程式為_____________。
(4)反應開始至2分鐘時,B的平均反應速率為__________。
(5)能說明該反應已達到平衡狀態的是_________(填字母)。
A.v(A)= 2v(B) B.容器內壓強保持不變
C.v逆(A)= v正(C) D.容器內混合氣體的密度保持不變
Ⅲ.已知:斷開1 mol共價鍵吸收的能量或形成1 mol共價鍵釋放的能量數據如下表:
共價鍵 | H—H | N—H | N≡N |
能量變化/kJ·mol1 | 436 | 390.8 | 946 |
(6)已知合成氨反應:N2(g)+3H2(g)![]() 2NH3(g),則N2(g)與H2(g)反應有2 mol NH3(g)生成時,能量的變化情況是_________(填“吸收”或“放出”以及具體數值)kJ。
2NH3(g),則N2(g)與H2(g)反應有2 mol NH3(g)生成時,能量的變化情況是_________(填“吸收”或“放出”以及具體數值)kJ。
【答案】 放熱 催化劑與反應物的接觸面積 2A+B![]() 2C 0.1 mol/(L·min) BC 放出90.8
2C 0.1 mol/(L·min) BC 放出90.8
【解析】(1)根據觸摸試管很燙分析;
(2)根據反應完成所需的時間判斷;
Ⅱ.(3)根據圖像分析;
(4)根據B的濃度變化量分析;
(5)在一定條件下,當可逆反應的正反應速率和逆反應速率相等時(但不為0),反應體系中各種物質的濃度或含量不再發生變化的狀態,稱為化學平衡狀態,據此解答。
Ⅲ.(6)根據ΔH=反應物的化學鍵斷裂吸收的能量-生成物的化學鍵形成釋放的能量計算。
I.(1)觸摸試管時很燙,說明該反應是放熱反應。
(2)實驗結果表明有粉末狀的二氧化錳的反應完成所需的時間少,催化效果更好,這說明催化劑的催化效果與催化劑的接觸面積有關。
Ⅱ.(3)反應進行到2min時各種物質的物質的量不再發生變化,反應達到平衡狀態,此時消耗A是5mol-3mol=2mol,消耗B是2mol-1mol=1mol,生成C是4mol-2mol=2mol,因此根據變化量之比是相應的化學計量數之比可知該反應的的化學方程式為2A+B![]() 2C。(4)反應開始至2分鐘時,消耗B的濃度是1mol÷5L=0.2mol/L,所以用B表示的平均反應速率為0.2mol/L÷2min=0.1mol/(L·min)。
2C。(4)反應開始至2分鐘時,消耗B的濃度是1mol÷5L=0.2mol/L,所以用B表示的平均反應速率為0.2mol/L÷2min=0.1mol/(L·min)。
(5)A.v(A)=2v(B)沒有指明反應的方向,不一定處于平衡狀態,A錯誤;B.正反應體積減小,則容器內壓強保持不變說明反應處于平衡狀態,B正確;C.v逆(A)=v正(C)表示正逆反應速率相等,反應處于平衡狀態,C正確;D.密度是混合氣的質量和容器容積的比值,在反應過程中質量和容積始終是不變的,因此容器內混合氣體的密度保持不變不能說明反應處于平衡狀態,D錯誤,答案選BC。
Ⅲ.(6)ΔH=反應物的化學鍵斷裂吸收的能量-生成物的化學鍵形成釋放的能量,則合成氨反應N2(g)+3H2(g)![]() 2NH3(g)的反應熱ΔH=946 kJ/mol+3×436 kJ/mol-2×3×390.8 kJ/mol=-90.8kJ·mol-1,即N2(g)與H2(g)反應有2 mol NH3(g)生成時,能量的變化情況是放出90.8kJ能量。
2NH3(g)的反應熱ΔH=946 kJ/mol+3×436 kJ/mol-2×3×390.8 kJ/mol=-90.8kJ·mol-1,即N2(g)與H2(g)反應有2 mol NH3(g)生成時,能量的變化情況是放出90.8kJ能量。


科目:高中化學 來源: 題型:
【題目】室溫下,將0.10molL﹣1的鹽酸滴入20mL0.10molL﹣1的氨水中,溶液的pH和pOH隨加入鹽酸體積變化的曲線如圖所示.已知:pOH=﹣lg c(OH﹣),下列說法正確的是( ) 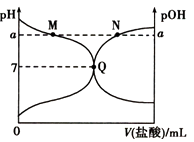
A.M點所示的溶液中c(NH4+)+c(NH3H2O)=c(Cl﹣)
B.Q點所示的溶液中c(NH4+)>c(Cl﹣)>c(H+)=c(OH﹣)
C.N點所示的溶液中c(NH4+)=c(Cl﹣)
D.M點和N點所示的溶液中水的電離程度相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】苯甲酸乙酯(C9H10O2)稍有水果氣味,用于配制香水香精和人造精油,大量用于食品工業中,也可用作有機合成中間體、溶劑等.其制備方法為:
![]() +C2H5OH
+C2H5OH![]()
![]() +H2O
+H2O
已知:
顏色、狀態 | 沸點(℃) | 密度(gcm﹣3) | |
苯甲酸* | 無色片狀晶休 | 249 | 1.2659 |
苯甲酸乙酯 | 無色澄清液體 | 212.6 | 1.05 |
乙醇 | 無色澄清液體 | 78.3 | 0.7893 |
環己烷 | 無色澄清液體 | 80.8 | 0.7318 |
*苯甲酸在100℃會迅速升華.實驗步驟如下:
①在圓底燒瓶中加入12.20g苯甲酸、25mL乙醇(過量)、20mL環己烷,以及4mL濃硫酸,混合均勻并加入沸石,按如圖所示裝好儀器,控制溫度在6570℃加熱回流2h.反應時環己烷一乙醇﹣水會形成“共沸物”(沸點62.6℃)蒸餾出來,再利用分水器不斷分離除去反應生成的水,回流環己烷和乙醇.
②反應結束,打開旋塞放出分水器中液體后,關閉旋塞.繼續加熱,至分水器中收集到的液體不再明顯增加,停止加熱.
③將燒瓶內反應液倒人盛有適量水的燒杯中,分批加入Na2CO3至溶液呈中性.
④用分液漏斗分出有機層,水層用25mL乙醚萃取分液,然后合并至有機層.加入氯化鈣,對粗產物進行蒸餾(裝置如圖所示),低溫蒸出乙醚后,繼續升溫,接收210213℃的餾分.
⑤檢驗合格,測得產品體積為13.16mL.
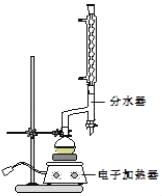
(1)在該實驗中,圓底燒瓶的容積最適合的是_____(填入正確選項前的字母).
A.25mL B.50mL C.100mL D.250mL
(2)步驟①中沸石的作用是____,使用分水器不斷分離除去水的目的是_____.
(3)驟②中應控制餾分的溫度在__.
A.215220℃ B.8590℃ C.7880℃ D.6570℃
(4)步驟③加入Na2CO3的作用是________;若Na2CO3加入不足,在之后蒸餾時,蒸餾燒瓶中可見到白煙生成,產生該現象的原因是________.
(5)關于步驟④中的萃取分液操作敘述正確的是____.
A.水溶液中加入乙醚,轉移至分液漏斗中,塞上玻璃塞,分液漏斗倒轉過來,用力振搖
B.振搖幾次后需打開分液漏斗下口的玻璃塞放氣
C.經幾次振搖并放氣后,手持分液漏斗靜置待液體分層
D.放出液體時,應打開上口玻璃塞或將玻璃塞上的凹槽對準漏斗口上的小孔
(6)計算本實驗的產率為____.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A原子的L層比B原子L層少3個電子,B原子核外電子總數比A原子多5個,由此AB可形成( )
A.離子化合物B2A3B.離子化合物B3A2C.共價化合物B3A2D.共價化合物B2A3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】組成生物體的各種化學元素中,最基本的元素、細胞鮮重中含量最多的元素、占細胞干重最多的元素依次是 ( )
A. C、H、O B. C、O、C C. C、O、N D. C、O、O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯化亞砜(SOCl2)是一種液態化合物,在農藥、制藥行業中用途廣泛。實驗室利用SO2、Cl2和 SCl2制備 SOCl2,部分裝置如下圖所示:
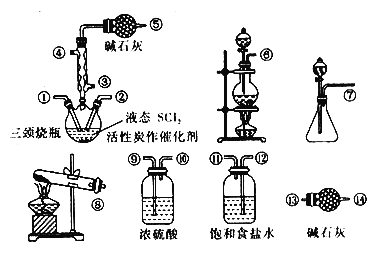
已知:①SOC12遇水劇烈反應,液面上產生白霧,并有氣體產生。
②SOC12沸點為77℃,SC12的沸點為 50 ℃。
請回答:
(1)實驗室制取SOCl2的反應方程式為___________。
(2)實驗室制取SOC12在三頸燒瓶中合成,整個裝置所選儀器的連接順序是⑥→ _____→①,_______→②(某些儀器可以重復使用)。
(3)使用冷凝管的作用是__________;冷凝管上連接的干燥管的作用是__________ 。
(4)實驗結束后,將三頸燒瓶中混合物分離實驗操作名稱是__________。
(5)若反應中消耗的Cl2的體積為896mL (已折算為標準狀況,SO2足量) 最后得到純凈的SOCl26.76g,則SOCl2的產率為_________(保留二位有效數字)。
(6)取少量的SOCl2加入足量NaOH溶液,振蕩靜置得到無色溶液,檢驗溶液中存在Cl-的方法是________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2SO2(g)+O2(g)![]() 2SO3(g)+Q,是接觸法生產硫酸的主要反應之一。
2SO3(g)+Q,是接觸法生產硫酸的主要反應之一。
完成下列填空:
(1)生產過程中溫度控制在400℃~500℃,目的是__________________________________;該反應無需加壓的原因是____________________________________________________。
(2)上述反應在密閉容器中達到化學平衡狀態的標志為______________________________。
(3)上述反應的平衡常數表達式為__________________________________,隨著溫度升高,平衡常數__________________(選填“增大”、“減小”或“不變”)。
(4)接觸法生產硫酸尾氣中含有SO2,可以采用氨水吸收,生成(NH4)2SO3與NH4HSO3的混合溶液。反應所得(NH4)2SO3又可以將NO2轉化為N2和(NH4)2SO4。
① 寫出生成NH4HSO3的化學方程式__________________________________________。
② 書寫NO2與(NH4)2SO3反應的化學方程式,標出該反應中電子轉移的方向和數目__________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com