
| A. | 該溫度下,反應的平衡常數(shù)是$\frac{1}{64}$ | |
| B. | 0~2min內(nèi),HI的平均反應速率為0.1mol•L-1•min-1 | |
| C. | 在恒容條件下,向該體系中充入HI氣體,平衡不移動,反應速率不變 | |
| D. | 升高溫度,平衡向正反應方向移動,只有正反應速率加快 |
分析 A.平衡時生成氫氣為0.1mol,根據(jù)方程式計算生成的n(I2)、參加反應的n(HI),進而計算平衡時HI的物質(zhì)的量,由于反應前后氣體的化學計量數(shù)相等,利用物質(zhì)的量代替濃度代入平衡常數(shù)表達式計算;
B.2min內(nèi)生成氫氣為0.1mol,根據(jù)v=$\frac{\frac{△n}{V}}{△t}$計算v(H2),再根據(jù)速率之比等于化學計量數(shù)之比計算v(HI);
C.恒壓下向該體系中加入N2,體積增大,反應混合物的濃度減小,反應速率減小,等效為降低壓強,結(jié)合化學計量數(shù)判斷平衡移動;
D.升高溫度正、逆反應速率都增大.
解答 解:A.平衡時生成氫氣為0.1mol,根據(jù)方程式計算生成的n(I2)=n(H2)=0.1mol,參加反應的n(HI)=2n(H2)=0.2mol,平衡時HI的物質(zhì)的量為1mol-0.2mol=0.8mol,由于反應前后氣體的化學計量數(shù)相等,利用物質(zhì)的量代替濃度計算平衡常數(shù),故平衡常數(shù)k=$\frac{0.1×0.1}{0.{8}^{2}}$=$\frac{1}{64}$,故A正確;
B.2min內(nèi)生成氫氣為0.1mol,故v(H2)=$\frac{\frac{0.1mol}{2L}}{2min}$=0.025mol•L-1•min-1,速率之比等于化學計量數(shù)之比,故v(HI)=2v(H2)=0.05mol•L-1•min-1,故B錯誤;
C.恒壓下向該體系中加入N2,體積增大,等效為降低壓強,該反應前后氣體的體積不變,平衡不移動.反應混合物的濃度減小,反應速率減小,故C錯誤;
D.升高溫度正、逆反應速率都增大,故D錯誤;
故選A.
點評 本題考查化學平衡圖象、影響化學平衡因素、化學反應速率計算及影響因素等,為高頻考點,側(cè)重于學生的分析能力的考查,難度中等,C選項注意根據(jù)濃度變化理解壓強的影響.


 新思維假期作業(yè)寒假吉林大學出版社系列答案
新思維假期作業(yè)寒假吉林大學出版社系列答案科目:高中化學 來源: 題型:選擇題
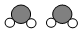 +
+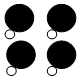 →
→ +4X.
+4X.| A. | 該反應屬于置換反應 | B. | 參加反應的兩種分子個數(shù)比為1:1 | ||
| C. | 1個X分子中含有3個原子 | D. | 1個X分子中含有3種不同的原子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 使pH試紙變深藍色的溶液中:K+、CO32-、Na+、AlO2- | |
| B. | 1.0mol/LKNO3溶液:H+、Fe2+、Cl-、SO42- | |
| C. | 與鋁反應產(chǎn)生H2的溶液中:Na+、Mg2+、HCO3-、SO42- | |
| D. | 能使碘化鉀淀粉試紙變藍的溶液中:Na+、NH4+、S2-、I- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加入鋁粉一定能產(chǎn)生大量H2 | |
| B. | 溶液中OH-的濃度一定為0.1mol•L-1 | |
| C. | 還可能大量存在Na+、NH4+‘Cl-、S2O32- | |
| D. | 通入少量 HCl 氣體可能會使溶液中水的電離程度增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鋅錳電池和堿性鋅錳電池的正極材料均是鋅 | |
| B. | 鋅錳電池中電解質(zhì)主要是NH4Cl,而堿性鋅錳電池中的電解質(zhì)主要是KOH | |
| C. | 堿性鋅錳電池不如鋅錳電池的壽命長 | |
| D. | 干電池放電之后還可再充電 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
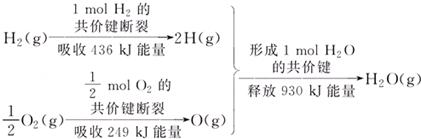
| A. | 1 mol H2的共價鍵形成放出436 kJ能量 | |
| B. | 氫氣跟氧氣反應生成水的同時吸收能量 | |
| C. | 1 mol H2(g)跟0.5mol O2(g)反應生成1 mol H2O(g)釋放能量245 KJ | |
| D. | 1 mol H2(g)與0.5mol O2(g)的總能量大于1 mol H2O(g)的能量 |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題

查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com