
【題目】某氯化鋇樣品23.1g中含有少量的氯化鈉,某同學進行了如圖所示的實驗.請計算:
①過濾后得到沉淀多少克?
②原樣品中氯化鋇的質量分數?(計算結果精確到0.1%)
③求D燒杯中所得溶液的溶質質量分數是多少?
【答案】解:①設生成碳酸鋇沉淀的質量為x,生成氯化鈉的質量為y,參加反應的氯化鋇的質量為z Na2CO3+BaCl2=BaCO3↓+2NaCl
106 208197 117
100g×10.6%zx y![]() ,
, ![]() ,
, ![]()
x=19.7g
y=11.7g
z=20.8g
所以過濾后得到沉淀是19.7g;
②原樣品中氯化鋇的質量分數為: ![]() ×100%=90.0%;
×100%=90.0%;
③D燒杯中所得溶液的溶質質量分數是: ![]() ×100%=7%.
×100%=7%.
故答案為:①過濾后得到沉淀是19.7g;②原樣品中氯化鋇的質量分數為90.0%;③D燒杯中所得溶液的溶質質量分數是7%.
【解析】①根據碳酸鈉和氯化鋇反應生成碳酸鋇沉淀和氯化鈉,依據碳酸鈉的質量進行計算;②根據化學方程式計算原混合物中氯化鋇的質量,然后計算氯化鋇的質量分數;③根據題中的數據計算反應后,溶液D中溶質和溶液的質量,然后進行計算.本題主要考查了化學方程式的計算,難度不大,注意解題的規范性和準確性.
【考點精析】解答此題的關鍵在于理解根據化學反應方程式的計算的相關知識,掌握各物質間質量比=系數×相對分子質量之比.


科目:高中化學 來源: 題型:
【題目】一定量的混合氣體在密閉容器中發生如下反應:xA(g)+yB(g)![]() zC(g),達到平衡后測得A氣體的濃度為0.5 mol·L-1,保持溫度不變,將密閉容器的容積壓縮為原來的一半再次達到平衡后,測得A濃度為0.8 mol·L-1,則下列敘述正確的是
zC(g),達到平衡后測得A氣體的濃度為0.5 mol·L-1,保持溫度不變,將密閉容器的容積壓縮為原來的一半再次達到平衡后,測得A濃度為0.8 mol·L-1,則下列敘述正確的是
A. 平衡向正反應方向移動 B. x+y<z
C. B的物質的量濃度減小 D. C的體積分數降低
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于SO2的敘述正確的是( )
A.SO2是具有漂白作用,可使石蕊褪色B.SO2與NaOH溶液反應生成Na2SO4
C.SO2能使溴水褪色,是因為SO2具有還原性D.SO2有毒,不能用作食品添加劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是
A. 一切物質中都存在化學鍵
B. 含有共價鍵的物質是共價化合物
C. 由非金屬元素組成的化合物是共價化合物
D. 兩個非金屬元素原子間不可能形成離子鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種以黃銅礦和硫磺為原料制取鋼和其他產物的新工藝,原料的綜合利用率較高。其主要流程如下:
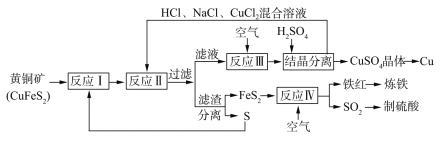
已知:“反應Ⅱ”的離子方程式為Cu2++CuS+4Cl-=2[CuCl2]-+S
回答下列問題:
(1)鐵紅的化學式為________;
(2)“反應Ⅱ”的還原劑是________(填化學式);
(3)除CuS外“反應II”的產物還有_________(填化學式);
(4)“反應Ⅲ”的離子方程式為_________;
(5)某同學設想利用電化學原理實現以CuSO4、SO2為原料制備Cu和H2SO4,并吸收煉鐵過程中產生的CO尾氣,實現資源與能源的綜合利用。該同學據此組裝出的裝置如下圖所示:

閉合該裝置中的K,A池中通入SO2的Pt電極的電極反應式為__________,B池中生成的氣體X的電子式為________,若在C池中生成64gCu,則整個裝置中共生成H2SO4_____mol。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有下列十種物質:①Na2O ②Cu(OH)2 ③Zn ④CaCO3 ⑤硫酸溶液 ⑥Ba(OH)2 ⑦干冰 ⑧A12(SO4)3 ⑨HCl水溶液 ⑩KHSO4
(1)其中屬于非電解質的有_____________(填序號)。
(2)往②中加入過量的0.1 mol/L⑩的水溶液,發生反應的離子方程式是___________,向所得溶液中繼續加入③,會產生無色氣泡,該反應的離子方程式是_____________________。
(3)焊接銅器時,可先用NH4Cl除去其表面的氧化銅再進行焊接,該反應可表示為:4CuO+2NH4Cl![]() 3Cu+CuCl2+N2↑+4H2O
3Cu+CuCl2+N2↑+4H2O
①用雙線橋標明電子轉移的方向和數目。______________________ 。
②該反應中,被氧化的元素是 ,氧化劑是__________________。
③還原劑與氧化產物的物質的量之比為_________________。
④反應中若產生0.2 mol的氮氣,則有_______________mol的電子轉移。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于反應4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s) ΔH=-444.3 kJ·mol-1 ΔS=-280.1 J·mol-1·K-1。在常溫、常壓下反應能自發進行,對反應的方向起決定性作用的是( )
A. 熵變 B. 溫度
C. 壓強 D. 焓變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖為實驗室制取氣體的常見裝置:
(1)儀器a的名稱是;
(2)以A為發生裝置,用高錳酸鉀制取氧氣,化學方程式為 , 試管口放一團棉花的作用是;
(3)以B為發生裝置制取二氧化碳,加入藥品之前要先檢查裝置的 , 收集二氧化碳通常選用(填標號);
(4)溫度、濃度、固體的顆粒大小等因素會影響反應速率.為研究實驗室制取二氧化碳的適宜條件,進行如
表四組實驗:
實驗編號 | 甲 | 乙 | 丙 | 丁 |
mg大理石 | 塊狀 | 塊狀 | 粉末狀 | 粉末狀 |
mg驗算(過量) | 稀鹽酸 | 濃鹽酸 | 稀鹽酸 | 濃鹽酸 |
①大理石與鹽酸反應的化學方程式是;
②實驗甲與對照(填編號),是為了研究固體反應物顆粒大小對反應速率的影響;
③上述實驗中,另一個影響反應速率的因素是 .
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com