
 .
. .常溫下,D2E2是一種橙黃色的液體,遇水易水解,并產生能使品紅褪色的氣體.下列說法中正確的是ACD.
.常溫下,D2E2是一種橙黃色的液體,遇水易水解,并產生能使品紅褪色的氣體.下列說法中正確的是ACD.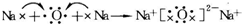 .
.分析 短周期主族元素A、B、C、D、E的原子序數依次增大,A原子的最外層電子數是次外層電子數的3倍,原子只能有2個電子層,最外層電子數為6,故A為O元素;A、D同主族,則D為S元素;E的原子序數最大,故E為Cl;B是短周期元素中原子半徑最大的主族元素,則B為Na;C原子的質子數比B原子的質子數多2個,則C為Al,據此解答.
解答 解:短周期主族元素A、B、C、D、E的原子序數依次增大,A原子的最外層電子數是次外層電子數的3倍,原子只能有2個電子層,最外層電子數為6,故A為O元素;A、D同主族,則D為S元素;E的原子序數最大,故E為Cl;B是短周期元素中原子半徑最大的主族元素,則B為Na;C原子的質子數比B原子的質子數多2個,則C為Al.
(1)由上述分析可知,B元素的名稱為:鈉,E的元素符號為:Cl,D的離子為S2-,離子結構示意圖為 ,故答案為:鈉;Cl;
,故答案為:鈉;Cl; ;
;
(2)A、B、D三種元素形成的簡單離子分別為O2-、Na+、S2-,電子層結構相同,核電荷數越大離子半徑越小,電子層越多離子半徑越大,故離子半徑:S2->O2->Na+,
故答案為:S2->O2->Na+;
(3)O、Na、S、Cl形成的化合物Na2O2、SCl2、Cl2O、ClO2中,過氧化鈉由鈉離子與過氧根離子過程,離子均滿足8電子結構,SCl2、Cl2O中各原子最外層電子數+|化合價|=8,均滿足8電子結構,ClO2中Cl原子不滿足8電子結構,
故答案為:Na2O2、SCl2、Cl2O;
(4)SCl2分子中S原子與Cl之間形成1對共用電子對,結構式為Cl-S-Cl,S2Cl2分子中S原子之間形成1對共用電子對,S原子與Cl原子之間形成1對共用電子對,電子式為 ;
;
A.A.S2Cl2中S與Cl原子之間的共用電子對偏向氯,故S元素顯+1價,故A正確;
B.S2Cl2結構中S原子與S原子之間形成非極性鍵,故B錯誤;
C.S2Br2與S2Cl2結構相似,均形成分子晶體,S2Br2的相對分子質量較大,分子之間范德華力較強,故熔沸點:S2Br2>S2Cl2,故C正確;
D.S2Cl2遇水易水解,并產生能使品紅褪色的氣體,該氣體為二氧化硫,根據電子轉移守恒可知,S元素化合價應降低,生成物中可能有單質硫,故D正確,
故答案為:Cl-S-Cl; ;ACD;
;ACD;
(5)用電子式表示O、Na兩種元素形成化合物Na2O的形成過程: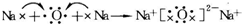 ,
,
故答案為: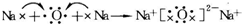 ;
;
(6)化合物Na2O2中鈉離子與過氧根離子之間形成離子鍵,過氧根離子中氧原子之間形成非極性鍵,
故選:bd;
(7)SO2與氯氣在水中反應生成HCl與硫酸,反應的化學方程式為:SO2+Cl2+2H2O=2HCl+H2SO4,
故答案為:SO2+Cl2+2H2O=2HCl+H2SO4;
(8)向由C、E兩種元素組成的化合物為AlCl3,其物質的量為0.2L×2mol/L=0.4mol,如完全生成沉淀,則應生成0.4molAl(OH)3,實際得到白色沉淀15.6g,物質的量為$\frac{15.6g}{78g/mol}$=0.2mol<0.4mol,說明Al3+沒有完全生成沉淀,可能存在兩種情況:
①NaOH不足,鋁離子部分轉化氫氧化鋁沉淀,則:
Al3++3OH-=Al(OH)3↓,
0.2mol 0.6mol 0.2mol
此時c(NaOH)=$\frac{0.6mol}{0.5L}$=1.2mol/L,
②NaOH部分過量,鋁離子轉化為氫氧化鋁沉淀、偏鋁酸根,則:
Al3++3 OH-=Al(OH)3↓
0.4mol 1.2mol 0.4mol
溶解的氫氧化鋁為0.4mol-0.2mol=0.2mol
Al(OH)3+OH-=AlO2-+2H2O,
0.2mol 0.2mol
則c(NaOH)=$\frac{1.2mol+1.2mol}{0.5L}$=2.8mol/L,
故答案為:1.2;2.8.
點評 本題考查結構性質位置關系綜合應用,推斷元素是解題關鍵,題目綜合性較強,需要學生具備扎實的基礎,(8)中注意根據沉淀的質量判斷發生的反應,側重于學生的分析能力和計算能力的考查,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 1.0×10-7mol•L-1 | B. | 1.0×10-6mol•L-1 | ||
| C. | 1.0×10-2mol•L-1 | D. | 1.0×10-12mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在潔凈的試管中加入1-2 mL AgNO3溶液,再加入過量濃氨水,振蕩,混合均勻 | |
| B. | 在潔凈的試管中加入1-2 mL濃氨水,再加入AgNO3溶液至過量 | |
| C. | 在潔凈的試管中加入1-2 mL稀氨水,再逐滴加入2%AgNO3溶液至過量 | |
| D. | 在潔凈的試管中加入2%AgNO3溶液1-2 mL,逐滴加入2%稀氨水至沉淀恰好溶解為止 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
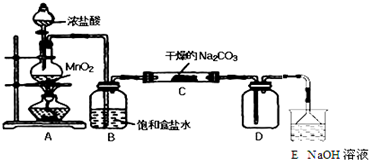
| 實 驗 步 驟 | 預 期 現 象 和 結 論 |
| 步驟1:取C中的少量固體樣品于試管中, 加入蒸餾水至固體溶解,然后各取1~2mL 所得溶液分別置于甲、乙兩支試管中. | 得到無色溶液. |
| 步驟2:向甲試管中加入過量的BaCl2溶液, 靜置. | 若溶液變渾濁,證明固體中含有Na2CO3. |
| 步驟3:取甲試管中上層清液少許于另一只 試管中,滴加少量澄清石灰水, 充分振蕩. | 若上層清液變渾濁, 證明固體中含有NaHCO3. |
| 步驟4:向乙試管中先加入過量的稀HNO3 稀HNO3;再滴入少量AgNO3溶液溶液. | 若生成白色沉淀;證明固體中含有氯化鈉. |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原混合溶液中c(K+)為4 mol•L-1 | |
| B. | 上述電解過程中共轉移4 mol電子 | |
| C. | 電解得到的Cu的物質的量為0.5 mol | |
| D. | 電解后溶液中c(H+)為2 mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑:Z<Y<W,而離子半徑:W<Y<Z | |
| B. | W的氯化物水溶液中滴加過量NaZ飽和溶液,可生成W的配合物用于冶金工業 | |
| C. | 由X、Y、Z組成鹽的水溶液呈酸性,則溶液中該鹽陽離子濃度大于酸根離子濃度 | |
| D. | 已知YX3沸點遠高于YZ3,則Y-X鍵的鍵能高于Y-Z鍵 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com