
| A. | 化學鍵是一種作用力 | |
| B. | 化學鍵可以使離子間相互結合,也可以使原子間相互結合 | |
| C. | 化學反應過程中反應物化學鍵斷裂,生成物化學鍵形成 | |
| D. | 氯化鈉固體溶于水沒有新物質生產,故沒有破壞化學鍵 |
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | ①②⑤ | B. | ②③④ | C. | ①③⑤ | D. | ①②③ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| t/s | 0 | 50 | 100 |
| c(N2O5)/mol•L-1 | 5.0 | 3.5 | 2.4 |
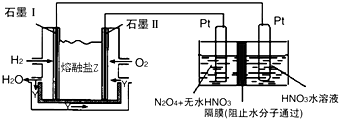
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 二氧化氯(C1O2)氣體是一種常用高效的自來水消毒劑.
二氧化氯(C1O2)氣體是一種常用高效的自來水消毒劑.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ;檢驗元素X、Y、Z以質量比為1:7:12形成的化合物中所含陽離子的離子反應方程式是:
;檢驗元素X、Y、Z以質量比為1:7:12形成的化合物中所含陽離子的離子反應方程式是:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 分子總數為NA的NO2和CO2混合氣體中含有的氧原子數為2NA | |
| B. | 28g乙烯(C2H4)和環丁烷(C4H8)的混合氣體中含有的碳原子數為2NA | |
| C. | 常溫常壓下,92g的NO2和N2O4混合氣體含有的原子總數為6NA | |
| D. | 17gOH-中含有的質子數為10NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| KCl | K2SO4 | ZnSO4 | ZnCl2 | |
| (1) | 0.3mol | 0.2mol | 0.1mol | / |
| (2) | 0.1mol | 0.3mol | / | 0.1mol |
| A. | 完全相同 | B. | 完全不同 | C. | 僅c(K+)相同 | D. | 僅c(Cl-)相同 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com