
【題目】根據下列熱化學方程式分析,C(s)的燃燒熱△H等于( )
C(s) + H2O(l) = CO(g) + H2(g) △H1=175.3kJ·mol-1
2CO(g) + O2(g) = 2CO2(g)△H2= —566.0 kJ·mol-1
2H2(g) + O2(g) = 2H2O(l) △H3= —571.6 kJ·mol-1
A.△H1+△H2—△H3B.2△H1+△H2+△H3
C.△H1+△H2/2 +△H3D.△H1+△H2/2 +△H3/2
科目:高中化學 來源: 題型:
【題目】實驗室利用二氧化錳和濃鹽酸反應制取Cl2,化學方程式如下:MnO2+4HCl(濃)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)請用單線橋標出該反應電子轉移的方向和數目__,該反應的氧化產物是__。
(2)其中氧化劑與還原劑的物質的量之比是__;若實驗中有87g的MnO2完全反應,則制得的Cl2在標況下的體積是__L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)N2H4可作火箭推進劑,NH3和NaClO在一定條件下反應可生成N2H4。
①寫出NH3和NaClO反應生成N2H4的_____;
②已知25℃時N2H4水溶液呈弱堿性:
N2H4+H2O![]() N2H5++OH- K1=1×10-a;N2H5++H2O
N2H5++OH- K1=1×10-a;N2H5++H2O![]() N2H62++OH- K2=1×10-b。
N2H62++OH- K2=1×10-b。
25℃時,向N2H4水溶液中加入H2SO4,欲使c(N2H5+)>c(N2H4),同時c(N2H5+)>c(N2H62+),應控制溶液中c(OH-)的范圍為_____________________(用含a、b式子表示)。
(2)常溫下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中:c(NH4+)_____c(HCO3-)(填“>”、“<”或“=”);反應NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常數K=_________。(已知常溫下NH3·H2O的電離平衡常數Kb=2×10-5,H2CO3的電離平衡常數K1=4×107mol·L1,K2=4×1011mol·L1)
NH3·H2O+H2CO3的平衡常數K=_________。(已知常溫下NH3·H2O的電離平衡常數Kb=2×10-5,H2CO3的電離平衡常數K1=4×107mol·L1,K2=4×1011mol·L1)
(3)25℃,將amol·L1的HCOONa溶液與0.01mol·L1鹽酸等體積混合,反應后測得溶液的pH=7,則Ka=_____________。(用含a的代數式表示不用化簡,不考慮液體混合時體積的變化)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下向某密閉容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三種氣體,圖 1 表示各物質濃度隨時間的變化,圖 2 表示速率隨時間的變化,t2、t3、t4、t5 時刻各改變一種條件,且改變的條件均不同。若t4時刻 改變的條件是壓強,則下列說法錯誤的是

A.若 t1=15 s,則前 15 s 的平均反應速率 v(C)=0.004 mol·L-1·s-1
B.該反應的化學方程式為 3A(g)![]() B(g)+2C(g)
B(g)+2C(g)
C.t2、t3、t5 時刻改變的條件分別是升高溫度、加入催化劑、增大反應物濃度
D.若 t1=15 s,則 B 的起始物質的量為 0.04 mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有下列八種有機物:![]() 乙烯、
乙烯、![]() 甲苯、
甲苯、![]() 溴乙烷、
溴乙烷、![]() 乙醇、
乙醇、![]() 苯酚、
苯酚、![]() 乙醛、
乙醛、![]() 乙酸、
乙酸、![]() 乙酸乙酯.請回答:
乙酸乙酯.請回答:
![]() 跟氯化鐵溶液反應的現象是______.
跟氯化鐵溶液反應的現象是______.
![]() 能夠與金屬鈉反應生成氫氣的是______
能夠與金屬鈉反應生成氫氣的是______![]() 填序號,下同
填序號,下同![]()
![]() 一定條件下能發生消去反應的是______.
一定條件下能發生消去反應的是______.
![]() 能跟銀氨溶液發生銀鏡反應的是______,寫出發生反應的化學方程式______.
能跟銀氨溶液發生銀鏡反應的是______,寫出發生反應的化學方程式______.
![]() 在一定條件下能與濃硝酸反應生成TNT的是______;寫出反應的化學方程式______.
在一定條件下能與濃硝酸反應生成TNT的是______;寫出反應的化學方程式______.
![]() 乙醇分子中不同的化學鍵如圖所示:
乙醇分子中不同的化學鍵如圖所示:
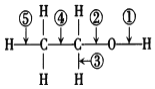
關于乙醇在下列反應中斷裂的化學鍵的說法不正確的是______![]() 填字母
填字母![]() .
.
A 和金屬鈉反應時![]() 鍵斷裂
鍵斷裂
B 和濃![]() 共熱至
共熱至![]() 時
時![]() 鍵斷裂
鍵斷裂
C 在Ag或Cu催化下和![]() 反應
反應![]() 鍵斷裂
鍵斷裂
D 在Ag![]() 反應
反應![]() 鍵斷裂.
鍵斷裂.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按要求填空:
(1)在第二周期中(稀有氣體除外),第一電離能最大的元素的原子結構示意圖是___,第一電離能最小的元素的電子排布圖為___。
(2)以下是一些原子的2p能級和3d能級中電子排布的情況.試判斷,哪些違反了泡利不相容原理,哪些違反了洪特規則。
①![]() ②
②![]() ③
③ ![]() ④
④![]() ⑤
⑤ ![]() ⑥
⑥ ![]()
違反泡利不相容原理的有__,違反洪特規則的有___。
(3)用VSEPR模型和雜化軌道理論相關知識填表:
分子或離子 | 中心原子軌道雜化形式 | 分子或離子的立體結構 | 分子有無極性 |
CH2O | ________ | _______ | _____ |
NH4+ | ________ | _______ | _____ |
CS2 | ________ | _______ | _____ |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在某2 L恒容密閉容器中充入2 mol X(g)和1 mol Y(g)發生反應:2X(g)+Y(g)![]() 3Z(g),反應過程中持續升高溫度,測得混合體系中X的體積分數與溫度的關系如圖所示。下列推斷正確的是( )
3Z(g),反應過程中持續升高溫度,測得混合體系中X的體積分數與溫度的關系如圖所示。下列推斷正確的是( )
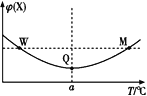
A.M點時,Y的轉化率最大B.升高溫度,平衡常數減小
C.W點時 v正 = v逆D.W、M兩點Y的正反應速率相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E為元素周期表中前三周期元素形成的五種離子,A、B、C、D四種離子的電子數均比E(雙核18電子離子)的電子數少8。
①A與B結合成的化合物甲中既有離子鍵又有共價鍵,A與C結合成的化合物乙難溶于水,乙溶于甲的水溶液得無色透明溶液,乙與甲的水溶液反應的離子方程式為__________;
②B與E結合成化合物丙,其中離子數之比為2∶1,A與D結合成化合物丁,丁與丙反應產生無色無味的氣體,該反應的化學方程式為_____________;
③H2、O2和甲的水溶液可形成氫氧燃料電池,負極的電極反應為:___________;
④有一種液態氮氫化合物戊,分子中氮與氫兩種元素的質量比為7∶1,與E的電子數相同,是火箭發射時使用的高能燃料之一,結構分析發現該分子結構中只有單鍵,與氨相似,則戊的結構式為_______,1mol戊與過量鹽酸反應的離子方程式是___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸工業生產過程中,涉及SO2轉化為SO3的反應,某化學研究小組在450 ℃時,在一容積為10 L 的恒容密閉容器中研究該可逆反應:2SO2(g)+O2(g)![]() 2SO3(g),得出的相關數據如表所示:
2SO3(g),得出的相關數據如表所示:
時間/min | n(SO2)/mol | n(O2)/mol | n(SO3)/mol |
0 | 0.200 | 0.100 | 0 |
10 | 0.190 | 0.095 | 0.010 |
15 | 0.160 | 0.080 | 0.040 |
20 | 0.160 | 0.080 | 0.040 |
25 | 0.150 | 0.150 | 0.050 |
根據表中數據,下列判斷正確的是
A. 0~10 min內的反應速率可表示為v(SO2)=0.010 mol/(L·min)
B. 15~20 min內,正、逆反應速率不相等
C. 工業上常用增加SO2的量來提高O2的轉化率
D. 20~25 min內,數據變化的原因可能是增加了O2的物質的量
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com