
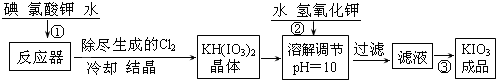
分析 (1)根據實驗操作可知,用四氯化碳檢驗碘時,需要用到萃取,則需要用到分液漏斗;
(2)由KIO3溶液得到KIO3成品,則需要蒸發結晶;根據蒸發結晶所需要的注意事項判斷;
(3)②反應中I2→KH(IO3)2,I元素化合價由0價升高為+5價,共升高10價.KClO3→KCl、Cl2,氯元素化合價降低,還原產物為KCl、Cl2,KClO3→KCl氯元素化合價由+5降低為-1價,化合價降低6價,KClO3→Cl2氯元素化合價由+5降低為0價,化合價總共降低10價,二者獲得的電子數目相同,獲得電子最小公倍數為30,則KCl的系數為5,Cl2的系數為3,所以化合價降低60價,故I2系數為6,根據元素守恒配平KClO3、H2O、KH(IO3)2的系數;
③根據反應的離子方程式可知,第②步生成的碘單質被消耗,則可選用與碘單質顯色的淀粉做指示劑;根據滴定操作注意事項回答;
(4)根據硫代硫酸鈉與碘酸鉀的關系式計算碘酸鉀的物質的量,再根據質量分數公式計算碘的含量.
解答 解:(1)根據實驗操作可知,用四氯化碳檢驗碘時,需要用到萃取,則需要用到分液漏斗,故答案為:分液漏斗;
(2)由KIO3溶液得到KIO3成品,則需要將溶劑蒸發掉,而得到晶體,該操作為蒸發結晶;當蒸發到較多晶體析出時,溶劑較少,為了防止形成的晶體KIO3受熱分解,應停止加熱,用儀器的余熱蒸干溶劑,
故答案為:蒸發結晶;當析出較多晶體時,應停止加熱,利用余熱蒸干;
(3)②反應中I2→KH(IO3)2,I元素化合價由0價升高為+5價,共升高10價.KClO3→KCl、Cl2,氯元素化合價降低,還原產物為KCl、Cl2,KClO3→KCl氯元素化合價由+5降低為-1價,化合價降低6價,KClO3→Cl2氯元素化合價由+5降低為0價,化合價總共降低10價,二者獲得的電子數目相同,獲得電子最小公倍數為30,則KCl的系數為5,Cl2的系數為3,所以化合價降低60價,故I2系數為6,根據元素守恒配平KClO3、H2O、KH(IO3)2的系數,化學方程式可寫為:1 KIO3+5 KI+3 H2SO4═3 K2SO4+3 I2+3 H2O,
故答案為:1、5、3、3、3、3;
③根據反應的離子方程式可知,第②步生成的碘單質被消耗,則可選用與碘單質顯色的淀粉做指示劑;滴定時,眼睛應時刻注視溶液顏色變化,防止滴定過量;滴定終點時,為了防止出現滴定不足或者滴定過量,應保持溶液半分鐘內顏色不變,
故答案為:淀粉; 錐形瓶內溶液顏色的變化;當滴入最后一滴時,溶液藍色剛好消失,且30秒內不恢復;
(4)設碘酸鉀的物質的量為x.
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O①; I2+2S2O32-=2I-+S4O62-②,將方程式②×3+①得
IO3-+6H++6S2O32-=I-+3S4O62-+3H2O
1 6
x 2.0×10-3mol/L×0.01L
x=$\frac{2.0×10{\;}^{-3}mol/L×0.01L}{6}$=$\frac{1}{3}$×10-5mol,根據碘原子守恒知,碘元素的質量=$\frac{1}{3}$×10-5mol/L×127g/mol=$\frac{127}{3}$×10-5g,
所以碘元素的質量分數=$\frac{\frac{127}{3}×10{\;}^{-5}}{w}$=$\frac{1270}{3w}$mg/kg,
故答案為:$\frac{1270}{3w}$.
點評 本題考查物質組成與含量的測定、對實驗原理理解、氧化還原滴定、閱讀獲取信息的能力等,難度較大,是對知識的綜合運用,理解實驗原理是解題的關鍵,需要學生具有扎實的基礎與綜合運用分析解決問題的能力.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 5 | B. | 6 | C. | 9 | D. | 10 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 燃料的脫硫脫氮、NO的催化轉化都是減少酸雨產生的措施 | |
| B. | 利用稀硝酸清除銅鏡表面的銅銹是因為稀硝酸具有強氧化性 | |
| C. | BaSO4難溶于水和強酸,在醫學上常用作鋇餐 | |
| D. | 食品包裝中常放入有硅膠和鐵粉的小袋,防止食物受潮和氧化變質 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CO、H2S的轉化率之比為1:1 | |
| B. | 達平衡后H2S的體積分數為29.4% | |
| C. | 升高溫度,COS濃度減小,表明該反應是吸熱反應 | |
| D. | 恒溫下向平衡體系中再加入CO、H2S、COS、H2各1 mol,平衡不移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
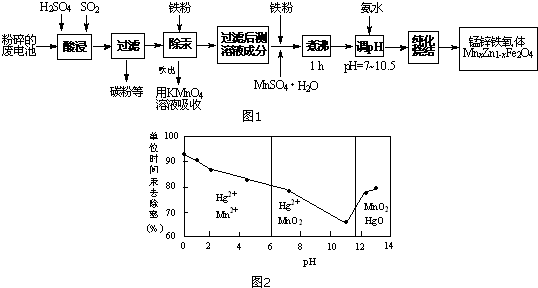
科目:高中化學 來源: 題型:解答題

| pH | Fe3+ | Zn2+ | Mn2+ | Cu2+ |
| 開始沉淀 | 1.9 | 6.0 | 8.1 | 4.7 |
| 沉淀完全 | 3.7 | 8.0 | 10.1 | 6.7 |
| 沉淀溶解 | 不溶解 | 10.5 | 不溶解 | / |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com