
【題目】A由Al2O3、Fe2O3、Al、Cu中的某幾種粉木混合而成,設計成份分析實驗方案如下,下列分析不正確的是

A. 當m1>m2時,固體中一定存在A1元素
B. 生成藍色溶液的離子方程式: Cu+2Fe3+=Cu2++2Fe2+
C. 當m2-m3=2.96g,Fe3O4的質量至少為2.32g
D. 溶液a中一定存在c(Na+)>c(A102-)>c(OH-)>c(H+)
【答案】D
【解析】A、當m1>m2時,說明至少有Al2O3、Al兩者中的一種,一定存在A1元素,選項A正確;B、Fe3O4與鹽酸反應生成氯化鐵和氯化亞鐵,三價鐵離子有強氧化性,發生Cu+2Fe3+═Cu2++2Fe2+,選項B正確;C、引固體質量改變的金屬氧化物的溶解,和三價鐵與銅單質之間的氧化還原反應,Cu+2Fe3+=Cu2++2Fe2+,Fe3O4~2Fe3+~Cu,也就是四氧化三鐵和銅的物質的量大于1:1,m2-m3=2.96g才符合,最小值為1:1,即2.96g×![]() ×100%=2.32 g,選項C正確;D、溶液a中若過量氫氧化鈉較多時,可能存在c(Na+)> c(OH-)> c(A102-) >c(H+),選項D不正確。答案選D。
×100%=2.32 g,選項C正確;D、溶液a中若過量氫氧化鈉較多時,可能存在c(Na+)> c(OH-)> c(A102-) >c(H+),選項D不正確。答案選D。


 口算心算速算應用題系列答案
口算心算速算應用題系列答案 同步拓展閱讀系列答案
同步拓展閱讀系列答案科目:高中化學 來源: 題型:
【題目】乙酰基扁桃酰氯是一種醫藥中間體。某研究小組以甲苯和乙醇為主要原料,按下列路線合成乙酰基扁桃酰氯。
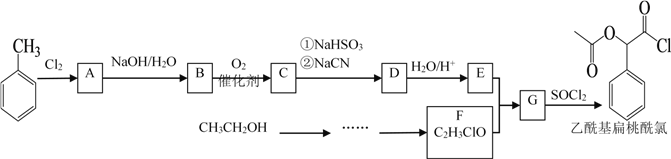
已知: ;
;![]() ;
;
![]()
請回答:
(1)甲苯與氯氣反應生成A的反應條件為________, B官能團的名稱是_______, D的結構簡式_________。
(2) 下列說法正確的是________。
A.化合物A不能發生取代反應
B.化合物B能發生銀鏡反應
C.化合物C能發生氧化反應
D.從甲苯到化合物C的轉化過程中,涉及到的反應類型有取代反應、加成反應和氧化反應
(3) E+F→G的化學方程式是____________________________。
(4)化合物D有多種同分異構體,同時符合下列條件的同分異構體共有____________種,寫出其中兩種的同分異構體的結構簡式____________________________。
①紅外光譜檢測表明分子中含有氰基(-CN);
②1H-NMR譜檢測表明分子中有苯環,且苯環上有兩種不同化學環境的氫原子。
(5) 設計以乙醇為原料制備F的合成路線(用流程圖表示;無機試劑任選)______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有8種物質:①乙烷;②乙烯;③乙炔;④苯;⑤甲苯;⑥溴乙烷;⑦聚乙烯;⑧環己烯。其中既不能使酸性KMnO4溶液褪色,也不能與溴水反應使溴水褪色的是( )
A. ①②③⑤B. ①④⑥⑦
C. ④⑥⑦⑧D. ②③⑤⑧
查看答案和解析>>
科目:高中化學 來源: 題型:
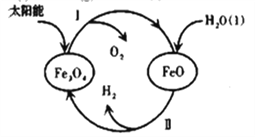
【題目】納米級Fe3O4呈黑色,因其有磁性且粒度小而在磁記錄材料、生物功能材料等諸多領域有重要應用,探究其制備和用途意義重大。
(1)還原-沉淀法:①用還原劑Na2SO3將一定量Fe3+可溶鹽溶液中的1/3Fe3+還原,使Fe2+和Fe3+的物質的量比為1:2。②然后在①所得體系中加入氨水,鐵元素完全沉淀形成納米Fe3O4。寫出②過程的離子方程式:__________________________。
當還原后溶液中c(Fe2+):c(Fe3+)=2:1時,由下表數據可知,產品磁性最大,可能的原因是___________________________ 。
c(Fe2+):c(Fe3+) | 沉淀性狀 | 磁性大小 |
1:3 | 紅棕色 | 92.7% |
1:2 | 棕色 | 96.5% |
2:1 | 黑色 | 100% |
(2)電化學法也可制備納米級Fe3O4,用面積為4cm2的不銹鋼小球(不含鎳、鉻)為工作電極,鉑絲作陰極,用Na2SO4溶液作為電解液,電解液的pH維持在10左右,電流50mA。生成Fe3O4的電極反應為________________________。
(3)已知:H2O(l)=H2(g)+1/2O2(g) △H=+285.5kJ·mol-1,以太陽能為熱源分解Fe3O4,經由熱化學鐵氧化合物循環分解水制H2的過程如下,完善以下過程Ⅰ的熱化學方程式。
過程Ⅰ:________________________________,
過程Ⅱ:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) △H=+128.9kJ·mol-1
(4)磁鐵礦(Fe3O4)常作冶鐵的原料,主要反應為:Fe3O4(s)+4CO(g)![]() 3Fe(s)+4CO2(g),該反應的△H<0,T℃時,在IL恒容密閉容器中,加入Fe3O4、CO各0.5mol,10min后反應達到平衡時,容器中CO2的濃度是0.4mol·L-1。
3Fe(s)+4CO2(g),該反應的△H<0,T℃時,在IL恒容密閉容器中,加入Fe3O4、CO各0.5mol,10min后反應達到平衡時,容器中CO2的濃度是0.4mol·L-1。
①T℃時,10min內用Fe3O4表示的平均反應速率為_____g·min-1。
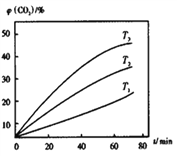
②其他條件不變時,該反應在不同溫度下,CO2含量隨時間的變化φ(CO2)-t曲線如圖所示,溫度T1、T2、T3由大到小的關系是_________________,判斷依據是___________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,Fe(OH)3(s)、Cu(OH)2(s)分別在溶液中達到沉淀溶解平衡后,改變溶液pH,金屬陽離子濃度的變化如圖所示。據圖分析,下列判斷錯誤的是( )
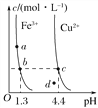
A. Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B. 加適量NH4Cl固體可使溶液由a點變到b點
C. c、d兩點代表的溶液中c(H+)與c(OH-)乘積相等
D. Fe(OH)3、Cu(OH)2分別在b、c兩點代表的溶液中達到飽和
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】丁烯是一種重要的化工原料,可由丁烷催化脫氫制備,正丁烷(C4H10)催化脫氫制1-丁烯(C4H8) 的化學方程式如下:C4H10(g)=C4H8(g)+H2(g)△H,如圖是該反應平衡轉化率與反應溫度及壓強的關系圖,下列說法正確的是
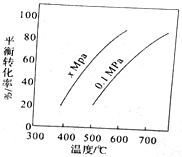
A. x>0.1
B. △H>O
C. 500C時,壓強xMPa比0.1MPa條件下的平衡常數大
D. 一定溫度下,在一恒容密閉容器中發生該反應,C4H10的濃度越高,平衡轉化率越大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某容積為1L的密閉容器中通入1mol CO2和3mol H2,發生反應:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0。下列有關說法正確的是
CH3OH(g)+H2O(g) ΔH<0。下列有關說法正確的是
A. 該反應在高溫下才能自發進行
B. 再加入一定量CO2,則n(CH3OH)/n(CO2)減小
C. 溫度升高,反應的平衡常數K增大
D. 當CO2和H2轉化率相等時,該反應達到化學平衡
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于元素的說法中,正確的是( )
A.生物體中的化學元素在無機自然界中都可找到
B.在生物體內能找到無機自然界中的所有元素
C.各種元素在地殼中的含量都很豐富
D.不同生物體的元素種類差別很大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】密閉容器中裝有1mol NaHCO3和0.8mol Na2O2,加熱充分反應后,容器內殘留的固體是( )
A. 0.8molNa2CO3和0.6molNaOH B. 0.5molNa2CO3和1molNaOH
C. 0.8molNa2CO3和1molNaOH D. 1molNa2CO3和0.6molNaOH
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com