
金屬銅廣泛地應用于電氣、機械制造、國防等領域。
(1)Cu是元素周期表中第29號元素,寫出第三周期基態原子未成對電子數與Cu相同且電負性最大的元素是 (填元素名稱)。
(2)CuO受熱易分解為Cu2O和O2,請從銅的原子結構來說明CuO受熱易分解的原因:
。
(3)下圖是銅的某種氧化物的晶胞示意圖。已知該晶胞的邊長為a cm,阿伏加德羅常數為NA,該晶體的密度為 。

(4)向硫酸銅溶液中滴加氨水會生成藍色沉淀,在滴加氨水到沉淀剛好全部溶解可得到深藍色溶液,繼續向其中加入極性較小的乙醇可以生成深藍色的[Cu(NH3)4]SO4·H2O沉淀。
①SO42-中S原子的雜化方式為 。
②NH3分子內的H—N—H鍵角 (填“大于”“等于”或“小于”)H2O分子內的H—O—H鍵角。
③S、N、O三種元素第一電離能由大到小的順序為 。
(8分)(1)氯(1分)
(2)Cu+ 的最外層電子排布為3d10,而Cu2+ 的最外層電子排布為3d9,因最外層電子排布達到全滿時穩定,所以固態Cu2O穩定性強于CuO(2分)
(3)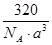 g/cm3(2分) (4)① sp3 (1分) ②大于(1分) ③ N>O>S(1分)
g/cm3(2分) (4)① sp3 (1分) ②大于(1分) ③ N>O>S(1分)
【解析】
試題分析:(1)銅元素基態原子未成對電子數是1個,則與三周期基態原子未成對電子數與Cu相同且電負性最大的元素是氟。
(2)根據構造原理可知,Cu+ 的最外層電子排布為3d10,而Cu2+ 的最外層電子排布為3d9,因最外層電子排布達到全滿時穩定,所以固態Cu2O穩定性強于CuO的,所以CuO受熱易分解為Cu2O和O2。
(3)根據晶胞結構特點可知,晶胞中銅原子的個數是8×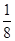 +6×
+6× =4,氧原子的個數也是4個,即該氧化物是CuO。應用晶胞的邊長為a cm,則
=4,氧原子的個數也是4個,即該氧化物是CuO。應用晶胞的邊長為a cm,則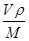 ×NA=4,因此晶胞的密度ρ=
×NA=4,因此晶胞的密度ρ=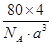 g/cm3=
g/cm3=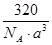 g/cm3。
g/cm3。
(4)①根據價層電子對互斥理論可知,SO2—4中S原子含有的孤對電子對數=(6+2-4×2)÷2=0,即SO2—4的立體構型是正四面體,所以S原子的雜化軌道類型是sp3雜化。
②由于水分子中氧原子含有2對孤對電子,排斥力強,而氨氣分子中含有1對孤對電子,所以NH3分子內的H—N—H鍵角大于H2O分子內的H—O—H鍵角。
③非金屬性越強,第一電離能越大,則氧元素的第一電離能大于S元素的。由于氮元素原子2p能級有3個電子,處于半滿穩定狀態,能量較低,第一電離能大于相鄰元素,所以S、N、O三種元素第一電離能由大到小的順序為N>O>S。
考點:考查元素判斷、物質穩定性、晶胞的計算、雜化軌道類型、鍵角比較、第一電離能比較等


 開心蛙口算題卡系列答案
開心蛙口算題卡系列答案科目:高中化學 來源: 題型:閱讀理解
查看答案和解析>>
科目:高中化學 來源:2013屆黑龍江省大慶實驗中學高三上學期開學考試化學試卷(帶解析) 題型:填空題
(15分)1、下列有關元素鍺及其化合物的敘述中正確的是 ___________
| A.鍺的第一電離能高于碳而電負性低于碳 |
| B.四氯化鍺與四氯化碳分子都是四面體構型 |
| C.二氧化鍺與二氧化碳都是非極性的氣體化合物 |
| D.鍺和碳都存在具有原子晶體結構的單質 |
查看答案和解析>>
科目:高中化學 來源:2012-2013學年黑龍江省高三上學期開學考試化學試卷(解析版) 題型:填空題
(15分)1、下列有關元素鍺及其化合物的敘述中正確的是 ___________
A.鍺的第一電離能高于碳而電負性低于碳
B.四氯化鍺與四氯化碳分子都是四面體構型
C.二氧化鍺與二氧化碳都是非極性的氣體化合物
D.鍺和碳都存在具有原子晶體結構的單質
2、銅在我國有色金屬材料的消費中僅次于鋁,廣泛地應用于電氣、機械制造、國防等領域。回答下列問題:
(1)銅原子基態電子排布式為 ;
(2)用晶體的x射線衍射法可以測得阿伏加德羅常數。對金屬銅的測定得到以下結果:晶胞為面心立方最密堆積,邊長為361pm。又知銅的密度為9.00g·cm-3,則阿伏加德羅常數為 (列式計算);
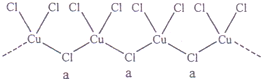
(3)氯和鉀與不同價態的銅可生成兩種化合物,這兩種化合物都可用于催化乙炔聚合,其陰離子均為無限長鏈結構(如下圖),a位置上Cl原子的雜化軌道類型為 。已知其中一種化合物的化學式為KCuCl3,另一種的化學式為 ;
(4)金屬銅單獨與氨水或單獨與過氧化氫都不能反應,但可與氨水和過氧化氫的混合溶液反應,其原因是 ,反應的化學方應程式為 。
查看答案和解析>>
科目:高中化學 來源:海南 題型:問答題

查看答案和解析>>
科目:高中化學 來源:2012年海南省高考化學試卷(解析版) 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com