
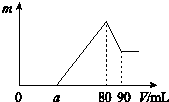
 把一定質量的鎂、鋁混合物投入到2mol•L-1的鹽酸中,待金屬完全溶解后,向溶液中加入2mol•L-1的氫氧化鈉溶液,生成沉淀的質量與加入氫氧化鈉溶液的體積關系如圖所示.
把一定質量的鎂、鋁混合物投入到2mol•L-1的鹽酸中,待金屬完全溶解后,向溶液中加入2mol•L-1的氫氧化鈉溶液,生成沉淀的質量與加入氫氧化鈉溶液的體積關系如圖所示.分析 0~a段沒有生成沉淀,說明鹽酸過量,加入的氫氧化鈉與氯化氫反應;a~80段開始生成沉淀,加入80mL氫氧化鈉溶液后沉淀達到最大量,此時溶液中的溶質為NaCl;80~90段氫氧化鋁開始溶解,溶解氫氧化鋁消耗了10mLNaOH,則氫氧化鋁沉淀的物質的量為:2mol/L×0.01L=0.02mol;當加入90mLNaOH溶液后氫氧化鋁完全溶解,此時沉淀只有氫氧化鎂.
(1)氫氧化鈉的體積在80至90mL段內,所有的氫氧化鈉用于溶解氫氧化鋁,根據氫氧化鈉的量確定氫氧化鋁的量,根據原子守恒確定金屬鋁的量;
(2)合金的組成可以采用極限假設法,當金屬全部是金屬鋁時剩余的酸最多,a的值最大來判斷a得取值范圍;
(3)加入80mL氫氧化鈉溶液時,溶質為NaCl,根據質量守恒可以計算出氯化氫的物質的量,再根據V=$\frac{n}{c}$計算出鹽酸的體積;
(4)根據圖象中消耗的氫氧化鈉的量確定合金中金屬鎂的最大量,進而確定該合金中兩元素物質的量之比的最大值;
(5)80~90ml對應反應為氫氧化鋁與氫氧化鈉反應生成偏鋁酸鈉和水,據此寫出反應的離子方程式.
解答 解:0~a段沒有生成沉淀,說明鹽酸過量,加入的氫氧化鈉與氯化氫反應;a~80段開始生成沉淀,加入80mL氫氧化鈉溶液后沉淀達到最大量,此時溶液中的溶質為NaCl;80~90段氫氧化鋁開始溶解,溶解氫氧化鋁消耗了10mLNaOH,則氫氧化鋁沉淀的物質的量為:2mol/L×0.01L=0.02mol;當加入90mLNaOH溶液后氫氧化鋁完全溶解,此時沉淀只有氫氧化鎂.
(1)從橫坐標80mL到90mL這段可以得出:n(Al(OH)3)=0.02mol,則n(Al)=n(Al(OH)3)=0.02mol,原混合物中鋁的質量為:27g/mol×0.02mol=0.54g,
故答案為:0.54;
(2)假設鹽酸溶解金屬后沒有剩余,此時酸恰好與合金反應完全,即a=0,通過極值法,當合金中完全是鋁時,因為沉淀Al3+需要消耗NaOH溶液的體積為30mL,從圖可知,中和過量的酸所消耗的堿液體積最大為50mL,但是假設不成立,最大值是不存在的,所以的取值范圍為 0≤a<50,
故答案為:0≤a<50;
(3)加入80mL氫氧化鈉溶液時,溶質為NaCl,則:n(HCl)=n(NaOH)=2mol/L×0.08L=0.16mol,
鹽酸的體積為:$\frac{0.16mol}{2mol/L}$=0.08L=80mL,
故答案為:80;
(4)n(Al)=n(Al(OH)3)=2mol•L-1×0.01L=0.02mol,所以沉淀Al3+需要消耗的OH-為0.06mol,即NaOH溶液的體積為30mL,鎂離子和鋁離子沉淀完全消耗的堿的體積為(80-a)mL,若假設鹽酸沒有剩余,所以沉淀Mg2+需要NaOH溶液的體積最大值為:80mL-30mL=50mL,
n (Mg)的最大值為:$\frac{2mol/L×0.05L}{2}$=0.05mol,所以該合金中鎂鋁兩元素物質的量之比的最大值為:0.05mol:0.02mol=2.5,
故答案為:2.5;
(5)根據分析可知,80~90ml對應反應的離子方程式:Al(OH)3+OH-=AlO2-+2H2O,
故答案為:Al(OH)3+OH-=AlO2-+2H2O.
點評 本題考查混合物有關計算,題目難度中等,明確圖象各階段發生的反應羧基解題的關鍵,注意守恒法在化學計算中的應用.


 開心蛙口算題卡系列答案
開心蛙口算題卡系列答案科目:高中化學 來源: 題型:選擇題
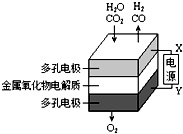 在固態金屬氧化物電解池中,高溫共電解H2O~CO2混合氣體制備H2和CO是一種新的能源利用方式,基本原理如圖所示.下列說法不正確的是( )
在固態金屬氧化物電解池中,高溫共電解H2O~CO2混合氣體制備H2和CO是一種新的能源利用方式,基本原理如圖所示.下列說法不正確的是( )| A. | X是電源的負極 | |
| B. | 陰極的反應式是:H2O+2eˉ═H2+O2- | |
| C. | 總反應可表示為:H2O+CO2═H2+CO+O2 | |
| D. | 陰、陽兩極生成的氣體的物質的量之比是2:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NO2-酸性氧化物 Na2O2-堿性氧化物 Al2O3-兩性氧化物 | |
| B. | 鹽酸-混合物 膽礬-純凈物 C60-單質 | |
| C. | 純堿-堿 硫化氫-酸 小蘇打-酸式鹽 | |
| D. | 液氯-非電解質 硫酸鋇-強電解質 醋酸-弱電解質 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 陽離子 | Na+、Ba2+、NH4+ |
| 陰離子 | CH3COO-、Cl-、OH-、SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. |  分散系的分類 | |
| B. |  醋酸稀釋 | |
| C. | 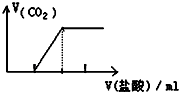 向Na2CO3溶液中逐滴滴入鹽酸 | |
| D. | 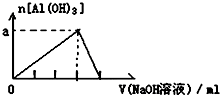 向AlCl3溶液中滴加過量的NaOH溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | c(Na+)═c(CH3COO-)+c(CH3COOH) | |
| B. | 0.1mol•L-1的CH3COONa溶液中:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 將CH3COONa溶解到醋酸中,CH3COONa抑制醋酸的電離 | |
| D. | 等物質的量濃度的CH3COONa、CH3COONH4溶液中c(CH3COO-)不相等 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
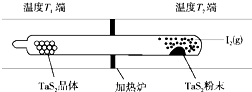 化學反應原理在科研和生產中有廣泛應用.
化學反應原理在科研和生產中有廣泛應用.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com