
化學計量在化學中占有重要地位,請回答下列問題:
(1)標準狀況下6.72 L NH3分子中所含原子數與 mL H2O所含原子數相等。
(2)已知16 g A和20 g B恰好完全反應生成0.04 mol C和31.76 g D,則C的摩爾質量為 。
(3)把V L含有MgSO4與K2SO4的混合溶液分成兩等份,一份加入含a mol NaOH的溶液,恰好使鎂離子完全沉淀為Mg(OH)2;另一份加入含b mol BaCl2的溶液,恰好使SO42-完全沉淀為BaSO4,則原混合溶液中鉀離子的物質的量濃度為________。(用a、b、V表示)
(1) 7.2 (2) 106 g/moL (3) 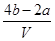 moL/L
moL/L
【解析】
試題分析:(1)根據n=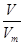 可知,在標準狀況下6.72 L NH3的物質的量=6.72L÷22.4L/mol=0.3mol
可知,在標準狀況下6.72 L NH3的物質的量=6.72L÷22.4L/mol=0.3mol
分子中含有原子的物質的量=0.3mol×4=1.2mol
由于水分子中含有3個原子,所以如果水分子中原子的物質的量是1.2mol
則水的物質的量=1.2mol÷3=0.4mol
其質量=0.4mol×18g/mol=7.2g
所以水的體積是7.2ml
(2)16 g A和20 g B恰好完全反應生成0.04 mol C和31.76 g D
則根據質量守恒定律可知,生成C的質量=16g+20g-31.76g=4.24g
所以C的摩爾質量=4.24g÷0.04mol=106g/mol
(3)一份加入含a mol NaOH的溶液,恰好使鎂離子完全沉淀為Mg(OH)2,則根據方程式可知
Mg2++2OH-=Mg(OH)2↓
1mol 2mol
0.5amol amol
另一份加入含b mol BaCl2的溶液,恰好使SO42-完全沉淀為BaSO4,則根據方程式可知
Ba2++SO42-=BaSO4↓
1mol 1mol
bmol bmol
因此原溶液中Mg2+和SO42-的物質的量分別是amol和2bmol
則根據溶液的電中性可知,原混合溶液中鉀離子的物質的量=4bmol-2amol
所以原混合溶液中鉀離子的物質的量濃度=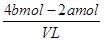 =
=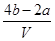 mol/L
mol/L
考點:考查物質的量、氣體摩爾體積、摩爾質量以及物質的量濃度的有關計算


 輕巧奪冠周測月考直通中考系列答案
輕巧奪冠周測月考直通中考系列答案科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
化學計量在化學中占有重要地位,請回答下列問題:
(1)現有mg某氣體,它由雙原子分子構成,其摩爾質量為Mg·mol-1。若阿伏加德羅常數用NA表示,則:
①該氣體的物質的量為________;
②該氣體所含原子總數為 個;
③該氣體在標準狀況下的體積為__________。
(2)與標準狀況下V LCO2所含氧原子數目相同的水的質量是_______(用分式表示)。
(3)在一定的溫度和壓強下,1體積氣體X2跟3體積氣體Y2化合生成2體積化合物,則該化合物的化學式是______________。
(4)某鹽混合溶液中含有離子:Na+、Mg2+ 、Cl-、SO42-,測得Na+、Mg2+ 和Cl-
的物質的量濃度依次為: 0.2mol·L-1、0.25 mol·L-1、0.4mol·L-1,則c(SO42-)=___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
(8分)化學計量在化學中占有重要地位,請回答下列問題:
(1)現有mg某氣體,它由雙原子分子構成,其摩爾質量為Mg·mol-1。若阿伏加德羅常數用NA表示,該氣體所含原子總數為 個;
(2)與標準狀況下V LCO2所含氧原子數目相同的水的質量是_______(用分式表示)。
(3)在一定的溫度和壓強下,1體積氣體X2跟3體積氣體Y2化合生成2體積化合物,則該化合物的化學式是______________。
(4)某鹽混合溶液中含有離子:Na+、Mg2+ 、Cl-、SO42-,測得Na+、Mg2+ 和Cl-
的物質的量濃度依次為: 0.2 mol·L-1、0.25 mol·L-1、0.4 mol·L-1,則c(SO42-)=___________ 。
查看答案和解析>>
科目:高中化學 來源:2011-2012年山東省濰坊市三縣高一上學期模塊學分認定檢測化學試卷 題型:填空題
化學計量在化學中占有重要地位,請回答下列問題:
(1)現有mg某氣體,它由雙原子分子構成,其摩爾質量為Mg·mol-1。若阿伏加德羅常數用NA表示,則:
①該氣體的物質的量為___ _____;
_____;
②該氣體所含原子總數為 個;
③該氣體在標準狀況下的體積為__________。
(2)與標準狀況下V LCO2所含氧原子數目相同的水的質量是_______(用分式表示)。
(3)在一定的溫度和壓強下,1體積氣體X2跟3體積氣體Y2化合生成2體積化合物,則該化合物的化學式是______________。
(4)某鹽混合溶液中含有離子:Na+、Mg2+、Cl-、SO42 -,測得Na+、Mg2
-,測得Na+、Mg2 +和Cl-
+和Cl-
的物質的量濃度依次為:0.2 mol·L-1、0.25 mol·L-1、0.4 mol·L-1,則c(SO42-)="___________" 。
查看答案和解析>>
科目:高中化學 來源:2014屆山東省高一12月學情調研考試化學試卷 題型:填空題
(8分)化學計量在化學中占有重要地位,請回答下列問題:
(1)現有mg某氣體,它由雙原子分子構成,其摩爾質量為Mg·mol-1。若阿伏加德羅常數用NA表示,該氣體所含原子總數為 個;
(2)與標準狀況下V LCO2所含氧原子數目相同的水的質量是_______(用分式表示)。
(3)在一定的溫度和壓強下,1體積氣體X2跟3體積氣體Y2化合生成2體積化合物,則該化合物的化學式是______________。
(4)某鹽混合溶液中含有離子:Na+、Mg2+ 、Cl-、SO42-,測得Na+、Mg2+ 和Cl-
的物質的量濃度依次為: 0.2 mol·L-1、0.25 mol·L-1、0.4 mol·L-1,則c(SO42-)=___________ 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com