
黃鐵礦(主要成分為FeS2)是工業制取硫酸的重要原料,其燃燒產物為SO2和Fe2O3。
(1)已知1g FeS2完全燃燒放出7.1kJ熱量,則表示FeS2完全燃燒反應的熱化學方程式為:
______________________________________________________________。
(2)將0.050molSO2(g)和0.030molO2(g)放入容積為1L的密閉容器中,反應:2SO2(g)+O2(g) 2SO3(g)
在一定條件下達到平衡,測得c(SO3)=0.040mol/L。則該條件下反應的平衡常數K的數值為___________,SO2的平衡轉化率為__________。
2SO3(g)
在一定條件下達到平衡,測得c(SO3)=0.040mol/L。則該條件下反應的平衡常數K的數值為___________,SO2的平衡轉化率為__________。
(3)當該反應處于平衡狀態時,欲使平衡向正反應方向移動且反應速率加快,下列措施可行的是 。(填字母)
A.向平衡混合物中充入Ar B.向平衡混合物中充入O2
C.改變反應的催化劑 D.降低反應的溫度
(4)反應:2SO2(g)+O2(g) 2SO3(g)
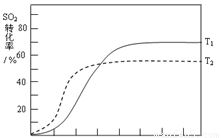
△H<0 , SO2的轉化率在起始溫度T1=673K下隨反應時間(t)的變化如下圖,其他條件不變,僅改變起始溫度為T2=723K,請在圖中畫出溫度T2下SO2的轉化率隨反應時間變化的預期結果示意圖。
2SO3(g)
△H<0 , SO2的轉化率在起始溫度T1=673K下隨反應時間(t)的變化如下圖,其他條件不變,僅改變起始溫度為T2=723K,請在圖中畫出溫度T2下SO2的轉化率隨反應時間變化的預期結果示意圖。

(1)4FeS2(s)+11O2(g) 2Fe2O3(s)+8SO2(g) △H=-3408kJ/mol (2分)
2Fe2O3(s)+8SO2(g) △H=-3408kJ/mol (2分)
(2)K=1.6×103 (2分) 80% (2分) (3)B(1分,多選不得分)
【解析】
試題分析:(1)FeS2完全燃燒燃燒的化學方程式是4FeS2+11O2 2Fe2O3+8SO2,由于1g FeS2完全燃燒放出7.1kJ熱量,則4molFeS2完全燃燒放出的熱量是7.1kJ×120×4=3408kJ,所以該反應的熱化學方程式是4FeS2(s)+11O2(g)
2Fe2O3+8SO2,由于1g FeS2完全燃燒放出7.1kJ熱量,則4molFeS2完全燃燒放出的熱量是7.1kJ×120×4=3408kJ,所以該反應的熱化學方程式是4FeS2(s)+11O2(g) 2Fe2O3(s)+8SO2(g) △H=-3408kJ/mol。
2Fe2O3(s)+8SO2(g) △H=-3408kJ/mol。
(2)
2SO2(g)+O2(g)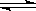 2SO3(g)
2SO3(g)
起始濃度(mol/L) 0.050 0.030 0
轉化濃度(mol/L) 0.040 0.020 0.040
平衡濃度(mol/L) 0.010 0.010 0.040
所以該溫度下平衡常數K=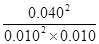 =1600
=1600
SO2的平衡轉化率=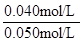 ×100%=80%
×100%=80%
(3)向平衡混合物中充入Ar,容器容積不變,濃度不變,反應速率和平衡狀態不變,A不正確;向平衡混合物中充入O2,增大反應物的濃度,反應速率增大,平衡向正反應方向移動,B正確;改變反應的催化劑平衡狀態不變,C不正確;降低反應的溫度,平衡向正反應方向移動,但反應速率降低,D不正確,答案選B。
(4)溫度高反應速率快,到達平衡的時間減少。由于正反應是放熱反應,所以溫度高不利于平衡向正反應方向進行,SO2的轉化率降低,因此正確的圖像是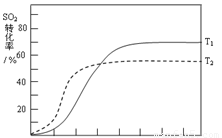 。
。
考點:考查熱化學方程式的書寫、平衡常數和轉化率的計算、外界條件對反應速率和平衡狀態的判斷以及可逆反應圖像的分析和判斷
點評:該題是高考中的常見考點和題型,屬于中等難度試題的考查,試題綜合性強,側重對學生能力的培養和解題方法的指導與訓練,旨在考查學生靈活運用基礎知識解決實際問題的能力,有利于培養學生的邏輯推理能力和發散思維能力,提升學生的學科素養。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源:2007年普通高等學校招生全國統一考試、化學(廣東卷) 題型:038
| |||||||||||||||||||
查看答案和解析>>
科目:高中化學 來源: 題型:
(1)將0.050 mol SO2(g)和0.030 mol O2(g)放入容積為![]() 2SO3(g)在一定條件下達到平衡,測得c(SO3)=0.040 mol·L-1。計算該條件下SO2的平衡轉化率(寫出計算過程)。
2SO3(g)在一定條件下達到平衡,測得c(SO3)=0.040 mol·L-1。計算該條件下SO2的平衡轉化率(寫出計算過程)。
(2)已知上述反應是放熱反應,當該反應處于平衡狀態時,在體積不變的條件下,下列措施中有利于提高SO2平衡轉化率的有___________(填字母)。
A.升高溫度 B.降低溫度 C.增大壓強 D.減小壓強 E.加入催化劑 F.移出氧氣
(3)SO2尾氣用飽和Na2SO3溶液吸收可得到更重要的化工原料,反應的化學方程式為___________________________。
(4)將黃鐵礦的煅燒產物Fe3O4溶于H2SO4后,加入鐵粉,可制備FeSO4。酸溶過程中需保持溶液足夠酸性,其原因是_______________________________________________________。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年四川省眉山市高三第一次診斷性考試化學試卷(解析版) 題型:填空題
硫酸渣是用黃鐵礦制造硫酸過程中排出的廢渣,主要化學成分為SiO2約45%,Fe2O3約40%,Al2O3約10%,MgO約5%。目前我國已經在技術上取得突破——從硫酸渣中分離出各種成分并加以利用。其流程和相關數據如下:

查資料得知:
|
物質名稱 |
溶度積(Ksp) |
pH值 |
|
|
開始沉淀 |
完全沉淀 |
||
|
Mg(OH)2 |
5.6×10-12 |
9.3 |
10.8 |
|
Fe(OH)3 |
2.8×10-16 |
2.7 |
3.7 |
|
Al(OH)3 |
1.3×10-33 |
3.7 |
4.7 |
請回答下列問題:
(1)寫出固體A的化學式為 。
(2)若要測定溶液的pH是否達到3.7,下列實驗用品中可選用的是 。
A.石蕊試液 B.廣泛pH試紙 C.精密pH試紙 D.pH計
(3)完成下列離子反應方程式
①溶液D生成固體E ; ②溶液F生成固體G 。
(4)要將固體C、固體E和固體G都轉化為相應的穩定氧化物,需進行的實驗操作為 。
(5)若不考慮溶液體積的變化,請計算溶液H中c(Mg2+)= 。
查看答案和解析>>
科目:高中化學 來源:同步題 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:
化學工業在國民經濟中占有極其重要的地位,江蘇省是國內最早的硫酸生產基地之一。主要方程式和主要設備: (黃鐵礦的主要成分為FeS2) 4FeS2+11O2 = 2Fe2O3+8SO2 (沸騰爐) 2SO2+O2![]() 2SO3 (接觸室) SO3+H2O=H2SO4(吸收塔)
2SO3 (接觸室) SO3+H2O=H2SO4(吸收塔)
(1)硫酸生產中,根據化學平衡原理來確定的條件或措施有 (填寫序號)。
A.礦石加入沸騰爐之前先粉碎 B.接觸室的反應使用V2O5作催化劑
C.接觸室中不使用很高的溫度 D.凈化后爐氣中要有過量的空氣
E.接觸室中的氧化在常壓下進行 F.吸收塔中用98.3%的濃硫酸吸收SO3
(2)0.1mol/L的NaHSO3溶液中,有關粒子濃度由大到小的順序為:
c (Na+)>c (HSO3-)>c (SO32-)>c (H2SO3)
①該溶液中c (H+) c (OH-)(填“>”、“=” 或“<” ),其理由是(用離子方程式表示): 。
②現向NaHSO3溶液中,逐滴加入少量含有酚酞的NaOH溶液,可觀察到的現象是 ,反應的離子方程式為: 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com