
【題目】H2O2作為氧化劑在反應時不產生污染物被稱為綠色氧化劑,因而受到人們越來越多的關注。為比較Fe3+和Cu2+對H2O2分解的催化效果,某化學研究小組的同學分別設計了如圖甲、乙所示的實驗。請回答下列問題:
(1)定性分析:圖甲可通過觀察________________定性比較得出結論。有同學提出將FeCl3溶液改為Fe2(SO4)3溶液更合理,其理由是_______________________。

(2)定量分析:如圖乙所示,實驗時均以生成40 mL氣體為準,其他可能影響實驗的因素均已忽略。圖中儀器A的名稱為_______,檢查該裝置氣密性的方法是:關閉A的活塞,將注射器活塞向外拉出一段后松手,過一段時間后看__________,實驗中需要測量的數據是__________。
(3)加入MnO2粉末于H2O2溶液中,在標準狀況下放出氣體的體積和時間的關系如圖所示。

由D到A過程中,隨著反應的進行反應速率逐漸_________。(填 “加快”或“減慢”),其變化的原因是_____________。(選填字母編號)
A.改變了反應的活化能 B.改變活化分子百分比
C.改變了反應途徑 D.改變單位體積內的分子總數
(4)另一小組同學為了研究濃度對反應速率的影響,設計了如下實驗設計方案,請幫助完成(所有空均需填滿)。
實驗編號 | T/K | 催化劑 | 濃度 |
實驗1 | 298 | 3滴FeCl3溶液 | 10ml 2%H2O2 |
實驗2 | 298 |
① 在實驗2中依次填_______________、________________。
② 可得到的結論是濃度越大,H2O2 分解速率__________。
【答案】 產生氣泡的快慢 將FeCl3溶液改為Fe2(SO4)3后與CuSO4對比只有陽離子不同,從而排出Cl-可能帶來的干擾 分液漏斗 活塞能否復位 生成40ml氣體所需的時間 減慢 D 3滴FeCl3 溶液 10ml 5%H2O2 【答題空10】越大
【解析】(1)該反應中產生氣體,可根據生成氣泡的快慢判斷,氯化鐵和硫酸銅中陰陽離子都不同,無法判斷是陰離子起作用還是陽離子起作用,硫酸鐵和硫酸銅陰離子相同,可以消除陰離子不同對實驗的干擾,故答案為:產生氣泡的快慢;將FeCl3溶液改為Fe2(SO4)3后與CuSO4對比只有陽離子不同,從而排出Cl-可能帶來的干擾;
(2)結合乙圖裝置,該氣密性的檢查方法為:關閉分液漏斗活塞,將注射器活塞拉出一定距離,一段時間后松開活塞,觀察活塞是否回到原位;反應是通過反應速率分析的,根據v=![]() ,所以,實驗中需要測量的數據是時間(或收集一定體積的氣體所需要的時間),故答案為:分液漏斗;活塞能否復位;產生40mL氣體所需的時間;
,所以,實驗中需要測量的數據是時間(或收集一定體積的氣體所需要的時間),故答案為:分液漏斗;活塞能否復位;產生40mL氣體所需的時間;
(3)由D到A過程中,隨著反應的進行,雙氧水的濃度逐漸減小,單位體積內的分子總數減少,活化分子數也減少,反應速率減慢,故答案為:減慢;D;
(4)① 根據實驗探究的目的:研究濃度對反應速率的影響,需要在其他條件不變時只改變濃度,因此在實驗2中依次填入3滴FeCl3 溶液、10ml 5%H2O2,故答案為:3滴FeCl3 溶液;10ml 5%H2O2;
②濃度越大,H2O2 分解速率越大,故答案為:越大。


 黃岡小狀元解決問題天天練系列答案
黃岡小狀元解決問題天天練系列答案科目:高中化學 來源: 題型:
【題目】銅和鎂的合金4.6g完全溶于濃硝酸,若反應中硝酸被還原只產生4480mL的NO2氣體和336mL的N2O4氣體(都已折算到標準狀況),在反應后的溶液中,加入足量的NaOH溶液,生成沉淀的質量為多少克?
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下向10mL0.1mol/L氨水中緩緩加蒸餾水稀釋到1L后,下列說法不正確的是
A. 電離程度增大,導電能力減弱 B. c(OH- )/c(NH3 ·H2O)增大
C. 溶液中OH- 數目減小 D. Kb (NH3 ·H2O)不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在某透明的強酸性溶液中,能大量共存的離子組是 ( )
A. Na+、NO3-、Fe2+、Cl-
B. Na+、SO42-、Ba2+、NO3-
C. MnO4-、K+、SO42-、Na+
D. K+、SO42-、HCO3-、Na+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物H是合成抗心律失常藥物決奈達隆的一種中間體,可通過以下方法合成:
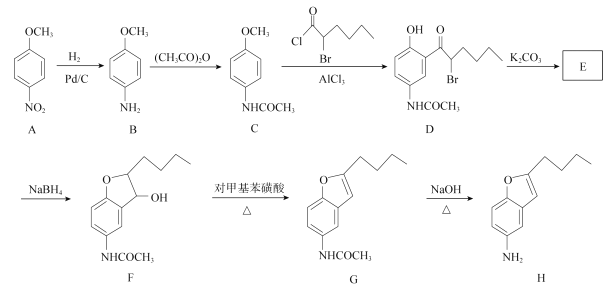
(1))D中的含氧官能團名稱為________________(寫三種)。
(2)F→G的反應類型為____________。
(3)寫出同時滿足下列條件的C的一種同分異構體的結構簡式:_______________________。
①能發生銀鏡反應
②能發生水解反應,其水解產物之一能與FeCl3溶液發生顯色反應
③分子中只有4種不同化學環境的氫。
(4)E經還原得到F,E的分子式為C14H17O3N,寫出E的結構簡式:________________________。
(5)已知:
①苯胺(![]() )易被氧化。
)易被氧化。
②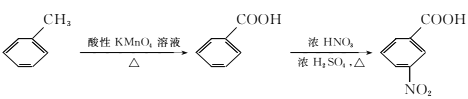
請以甲苯和(CH3CO)2O為原料制備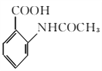 ,寫出制備的合成路線流程圖(無機試劑任用,合成路線流程圖示例見本題題干)。 ______________________
,寫出制備的合成路線流程圖(無機試劑任用,合成路線流程圖示例見本題題干)。 ______________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】多晶硅是單質硅的一種形態,是制造硅拋光片、太陽能電池及高純硅制晶的主要原料。已知多晶硅第三代工業制取流程如圖所示:
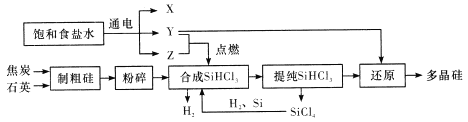
下列說法錯誤的是
A. Y、Z分別為H2、Cl2
B. 制取粗硅的過程中焦炭與石英會發生副反應生成碳化硅,在該副反應中,氧化劑與還原劑的物質的量之比為1:1
C. SiHCl3極易水解,其完全水解的產物為H2SiO3、H2、HCl,據此推測SiHCl3中硅元素的化合價為+2價
D. Y與SiHCl3制備多晶硅的反應屬于置換反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】金屬鎳有廣泛的用途,粗鎳中含有少量Fe、Zn、Cu、Pt等雜質,以硫酸鎳 溶液為電解液進行粗鎳 提純,下列說法正確的是(已知:氧化性的強弱順序為Fe2+<Ni2+<Cu2+)
A. 陽極首先發生的電極反應是Ni2++2e-=Ni
B. 電解過程中,陽極質量的減少與陰極質量的增加相等
C. 電解后,溶液中存在金屬陽離子只有Fe2+和Zn2+
D. 電解后,Cu和Pt沉積在電解槽底部形成陽極泥
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com