
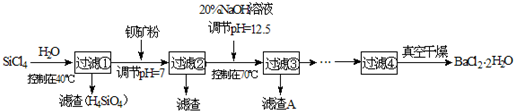
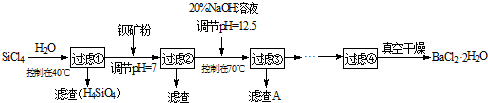
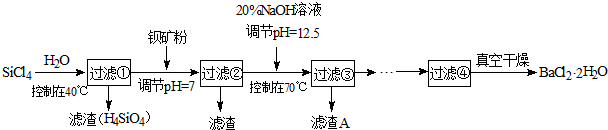
多晶硅(硅單質的一種)被稱為“微電子大廈的基石”,制備中副產物以SiCl4為主,它環境污染很大,能遇水強烈水解,放出大量的熱。研究人員利用SiCl4水解生成的鹽酸和鋇礦粉(主要成分為BaCO3,且含有鐵、鎂等離子)制備BaCl2·2H2O,工藝流程如下:

已知:
①常溫下Fe3+、Mg2+完全沉淀的pH分別是3.4、12.4
②BaCO3的相對分子質量是197;BaCl2·2H2O的相對分子質量是244
回答下列問題:
(1)SiCl4發生水解反應的化學方程式為_______________________________________
(2)用H2還原SiCl4蒸汽可制取純度很高的硅,當反應中有1mol電子轉移時吸收59KJ熱量,則該反 應的熱化學方程式為_____________________________________________
(3)加鋇礦粉并調節pH=7的目的是① ,②
(4)過濾②后的濾液中Fe3+濃度為 (濾液溫度25℃,Ksp[Fe(OH)3]=2.2×10-38)
(5)生成濾渣A的離子方程式__________________________________________
(6)列式計算出10噸含78.8% BaCO3的鋇礦粉理論上最多能生成BaCl2·2H2O的質量為多少噸?
(14分,第2、6問各3分,其他各2分)(1)SiCl4+4H2O=H4SiO4↓+4HCl
(2)SiCl4(s)+2H2(g)=Si(s)+4HCl(s) △H=+236kJ/mol
(3)使BaCO3轉化為BaCl2;使Fe3+完全沉淀 (4)2.2×10-17mo/L
(5)Mg2++2OH-=Mg(OH)2↓ (6)=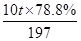 ×244=9.76t
×244=9.76t
【解析】
試題分析:(1)氯化硅水解生成原硅酸和氯化氫,水解方程式為SiCl4+4H2O=H4SiO4↓+4HCl。
(2)在反應中硅元素的化合價從+4價降低到0價,得到4個電子。當反應中有1mol電子轉移時吸收59KJ熱量,則消耗1mol氯化硅是吸收的熱量是59kJ×4=236kJ,因此該反應的熱化學方程式為SiCl4(s)+2H2(g)=Si(s)+4HCl(s) △H=+236kJ/mol。
(3)pH=3.4時,三價鐵離子完全生成沉淀;鹽酸和碳酸鋇反應生成氯化鋇和二氧化碳、水,所以加鋇礦粉并調節pH=7的作用是使BaCO3轉化為BaCl2,同時使Fe3+完全沉淀。
(4)溶液的pH=7,則溶液中 c(OH-)=1×10-7mo/L,則共計氫氧化鐵的溶度積常數可知,濾液中Fe3+濃度=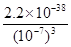 =2.2×10-17mo/L。
=2.2×10-17mo/L。
(5)由于濾液中還含有鎂離子,所以需要調節溶液的pH=12.5,使鎂離子完全沉淀生成氫氧化鎂,反應的離子方程式是Mg2++2OH-=Mg(OH)2↓
(6)根據鋇原子守恒可知,10噸含78.8% BaCO3的鋇礦粉理論上最多能生成BaCl2·2H2O的質量為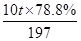 ×244=9.76t。
×244=9.76t。
考點:考查制備實驗方案的設計;熱化學方程式的書寫;難溶電解質的溶解平衡及沉淀轉化的計算;物質制備的計算等


科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源:2012-2013學年福建省四地六校高三第三次月考化學試卷(解析版) 題型:實驗題
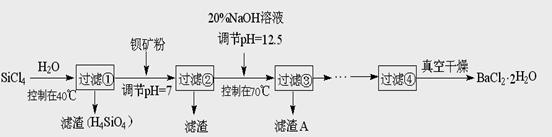
(12分)多晶硅(硅單質的一種)被稱為“微電子大廈的基石”,制備中副產物以SiCl4為主,它環境污染很大,能遇水強烈水解,放出大量的熱。研究人員利用SiCl4水解生成的鹽酸和鋇礦粉(主要成分為BaCO3,且含有鐵、鎂等離子),制備BaCl2.2H2O,工藝流程如下:
已知:
①常溫下Fe3+、Mg2+完全沉淀的PH分別是3.4、12.4
②BaCO3的相對分子質量是197;BaCl2.2H2O的相對分子質量是244
回答下列問題:
⑴SiCl4發生水解反應的化學方程式_______________________________________
⑵SiCl4用H2還原可制取純度很高的硅,當反應中有1mol電子轉移時吸收59KJ熱量,則該反應的熱化學方程式為_____________________________________________
⑶加鋇礦粉調節PH=7的作用是①使BaCO3轉化為BaCl2 ②_______________________
⑷生成濾渣A的離子方程式__________________________________________
⑸BaCl2濾液經______、________、過濾、_________,再經真空干燥后得到BaCl2.2H2O
⑹10噸含78.8% BaCO3的鋇礦粉理論上最多能生成BaCl2.2H2O___________噸。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com