
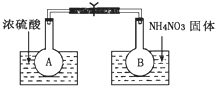
 已知2NO2(g)═N2O4(g)△H(298K)=-52.7kJ•mol-1,某課外活動小組為了探究溫度和壓強對化學平衡的影響,做了如下兩組實驗:
已知2NO2(g)═N2O4(g)△H(298K)=-52.7kJ•mol-1,某課外活動小組為了探究溫度和壓強對化學平衡的影響,做了如下兩組實驗:分析 (1)濃硫酸稀釋時放出熱量,導致溶液的溫度升高,硝酸銨溶解時吸收熱量,導致溶液的溫度降低,升高溫度平衡向吸熱方向移動,降低溫度,平衡向放熱方向移動;
(2)根據氣體顏色的變化確定移動方向;
(3)Kc=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$;升高溫度,平衡向吸熱反應方向移動,根據平衡移動方向確定二氧化氮的轉化率.
解答 解:(1)濃硫酸稀釋時放出熱量,導致溶液的溫度升高,硝酸銨溶解時吸收熱量,導致溶液的溫度降低,反應2NO2(g)?N2O4(g)是放熱反應,A燒杯中,升高溫度,平衡向逆反應方向移動,二氧化氮氣體濃度增大,氣體顏色加深,降低溫度,平衡向正反應方向移動,二氧化氮濃度降低,所以氣體顏色變淺,故答案為:氣體顏色加深,氣體顏色變淺;
(2)由以上分析知,降低溫度,平衡向正反應方向移動,故答案為:正;
(3)Kc=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$,升高溫度,平衡向逆反應方向移動,導致二氧化氮轉化率降低,
故答案為:Kc=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$;減小.
點評 本題考查了溫度、壓強對化學平衡的影響,難度不大,根據勒夏特里原理來分析解答即可.


 名校練考卷期末沖刺卷系列答案
名校練考卷期末沖刺卷系列答案科目:高中化學 來源: 題型:填空題
 ,屬于取代反應;
,屬于取代反應;查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 裝置 | B | F | G |
| 實驗現象 | |||
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 陳述I | 陳述Ⅱ | 判斷 |
| A | 銅綠的主要成分是堿式碳酸銅 | 可用稀鹽酸除銅器表面的銅綠 | Ⅰ對;Ⅱ對 無 |
| B | 銅綠的主要成分是堿式碳酸銅 | 銅制容器可以盛放濃硫酸 | I對;Ⅱ對;有 |
| C | 向硫酸銅溶液通足量氨氣.有深藍色沉淀產生,過濾后灼燒濾渣,最后變成黑色固體 | 把銅絲放在酒楕燈火焰上灼燒銅絲表面變黑 | I對;Ⅱ對;有 |
| D | 藍色硫酸銅晶體受熱轉化為白色硫酸銅粉末是物理變化 | 硫酸銅溶液可用作游泳池的消毒劑 | 錯;Ⅱ對;無 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 28 g氮氣含有的原子數為NA | |
| B. | 4 g金屬鈣變成鈣離子時失去的電子數為0.1NA | |
| C. | 1 mol O2分子的質量等于1 mol氧原子的質量 | |
| D. | 24 g O2分子和24 g O3分子所含的氧原子數目相等 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com