
【題目】一定溫度下,在容積為2L的密閉容器中進行反應:aN(g)![]() bM(g),M、N的物質的量隨時間的變化曲線如下圖所示:
bM(g),M、N的物質的量隨時間的變化曲線如下圖所示:

(1)此反應的化學方程式中,已知計量系數比為最簡整數比,則b=______。
(2)若t2-t1=10 min,則從t1到t2時刻,以M的濃度變化表示該反應的平均反應速率,計算出來的結果為_______mol/(L·min)。
(3)t1、t2、t3三個時刻中,______時刻達到反應的最大限度。
【答案】1 0.05 t3
【解析】
(1)化學方程式的系數數比等于物質的量變化量之比;
(2)根據![]() 計算以M的濃度變化表示該反應的平均反應速率;
計算以M的濃度變化表示該反應的平均反應速率;
(3)物質的量不再隨時間延長而變化時達到反應的最大限度。
(1)N的物質的量變化是8-2=6mol,M的物質的量變化是5-2=3mol,化學方程式的系數數比等于物質的量變化量之比,所以a:b=6:3=2:1,所以b=1;
(2)容積為2L,t2-t1=10 min,則從t1到t2時刻,M的物質的量變化5-4=1mol,所以![]() 0.05 mol/(L·min);
0.05 mol/(L·min);
(3)t3時刻M、N的物質的量不再隨時間延長而變化,所以t3時刻達到反應的最大限度。


科目:高中化學 來源: 題型:
【題目】下列說法不正確的是
A. 石油裂解氣可以使溴水褪色,也可以使高錳酸鉀溶液褪色
B. 可以用新制的氫氧化銅檢驗乙醇中是否含有乙醛
C. 正丙醇(CH3CH2CH2OH)和鈉反應要比水和鈉反應劇烈
D. CH2=CHCH3+Cl2 ![]() CH2=CHCH2 Cl+ HCl屬于取代反應
CH2=CHCH2 Cl+ HCl屬于取代反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用下面的方案進行某些離子的檢驗,其中方案設計嚴密的是( )
A. 檢驗試液中的SO42-:試液![]() 無沉淀
無沉淀![]() 白色沉淀
白色沉淀
B. 檢驗試液中的SO32-:試液![]() 氣體
氣體![]() 褐色
褐色
C. 檢驗試液中的I—:無色試液![]() 棕黃色溶液
棕黃色溶液![]() 藍色溶液
藍色溶液
D. 檢驗試液中的CO32-:試液![]() 白色沉淀
白色沉淀![]() 沉淀溶解
沉淀溶解
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定溫度下,反應A2(g)+B2(g)![]() 2AB(g)達到化學平衡狀態的標志是( )
2AB(g)達到化學平衡狀態的標志是( )
A. 容器內A2、B2、AB三種氣體的濃度相等
B. 單位時間內有a mol A2生成,同時就有amolB2消耗
C. 容器內氣體的總質量不隨時間變化而變化
D. 單位時間內有b molB2消耗,同時就有b molAB被分解
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,下列溶液的離子濃度關系式正確的是( )
A. 0.1molL-1NaHCO3溶液中:C(Na+)+C(H+)=C(HCO3-)+C(CO32-)+C(OH-)
B. Na2CO3溶液中:C(OH-)=C(H+)+C(HCO3-)+2C(H2CO3)
C. Na2S溶液中:2C(Na+)= C(S2-)+C(HS-)+C(H2S)
D. pH相同的①CH3COONa、②NaOH、③NaClO三種溶液的c(Na+):③>①>②
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞氯酸鈉(NaClO2)是一種重要的消毒劑,可用ClO2為原料制取。某化學興趣小組同學展開對漂白劑亞氯酸鈉(NaClO2)的研究。
已知:飽和NaClO2溶液在溫度低于38 ℃時析出的晶體是NaClO2·3H2O,高于38 ℃時析出的晶體是NaClO2,高于60 ℃時 NaClO2分解成NaClO3和NaCl。Ba(ClO2)2可溶于水。
利用圖所示裝置進行實驗。
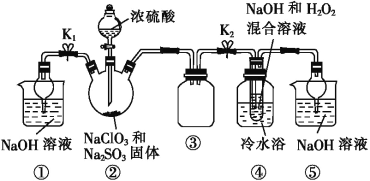
(1)裝置①的作用是___________________,裝置③的作用是________________。
(2)裝置②中制備ClO2的化學方程式為___________________________;裝置④中反應生成NaClO2的化學方程式為_____________________。
(3)從裝置④反應后的溶液中獲得NaClO2晶體的操作步驟為:①減壓,55 ℃蒸發結晶;②趁熱過濾;③__________________;④低于60 ℃干燥,得到成品。如果撤去④中的冷水浴,可能導致產品中混有的雜質是______________。
(4)設計實驗檢驗所得NaClO2晶體是否含有雜質Na2SO4,操作與現象是取少量晶體溶于蒸餾水,__________________________________________________________。
(5)為了測定NaClO2粗品的純度,取10.0 g上述初產品溶于水配成1 L溶液,取出10 mL溶液于錐形瓶中,再加入足量酸化的KI溶液,充分反應后(NaClO2被還原為Cl-,雜質不參加反應),加入2~3滴淀粉溶液,用0.20 mol·L-1的Na2S2O3標準液滴定,重復2次,平均消耗Na2S2O3溶液20.00 mL,計算得NaClO2粗品的純度為_____。(提示:2Na2S2O3+I2=Na2S4O6+2NaI)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CuSO4有關制備途徑及性質如圖所示。下列說法不正確的是 ( )
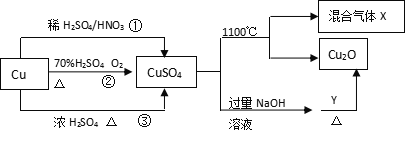
A. 途徑①所用混酸中H2SO4與HNO3物質的量之比最好為3:2
B. 相對于途徑①、③,途徑②更好地體現了綠色化學思想
C. 1molCuSO4在1100℃所得混合氣體X中O2可能為0.75mol
D. Y可能具有還原性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常見的太陽能電池有單晶硅太陽能電池、多晶硅太陽能電池、砷化鎵(GaAs)太陽能電池及銅銦鎵硒薄膜太陽能電池等。
(1)鎵元素位于元素周期表的____周期_____族,砷原子核外的電子有___種運動狀態。
(2)Si、P、S 的第一電離能由大到小的順序是 _____________, 二氧化硅和干冰晶體的熔點差別很大,其原因是________________________________________________。
(3)與AsF3互為等電子體的分子為___________(只寫一中),其空間構型為_________。
(4)硼酸(H3BO3)本身不能電離出H+,在水溶液中易結合一個OH-生成[B(OH)4]-,而體現弱酸性。
①[B(OH)4]-中B原子的雜化類型為______________。
②[B(OH)4]-的結構式為________________。
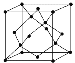
(5)金剛石的晶胞如圖所示,若以硅原子代替金剛石晶體中的碳原子,便得到晶體硅;若將金剛石晶體中一半的碳原子換成硅原子,且碳、硅原子交替,即得到碳化硅晶體(金剛砂)。
①金剛石、晶體硅、碳化硅的熔點由高到低的排列順序是________________(用化學式表示);
②金剛石的晶胞參數為a pm(1 pm=10-12 m)。 金剛石晶胞的密度為_________g/cm3(只要求列算式,阿伏加德羅常數為NA)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com