
【題目】下列物質的電子式書寫不正確的是
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
科目:高中化學 來源: 題型:
【題目】下列反應中,第一步反應生成的沉淀經第二步反應后質量增加的是
A. 將少量FeCl2溶液加入到NaOH溶液中,再滴加H2O2溶液
B. 將少量AgNO3溶液滴加到NaBr溶液中,再滴加Na2S溶液
C. 將少量CO2(g)通入飽和Ca(OH)2溶液中,再通入過量Cl2(g)
D. 將少量Ba(OH)2溶液滴加到入A12(S04)3溶液中,再加入過量NaOH溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵及其化合物在日常生活中用途比較廣泛。
(1)高鐵酸鈉(Na2FeO4)是一種新型的綠色消毒劑和高容量電池材料。將Fe(NO3)3與NaClO混合后,在堿性條件下發生反應可制得高鐵酸鈉,該反應的離子方程式為_____________________________________。
(2)四氧化三鐵(Fe3O4)常用作顏料、磁流體材料、催化劑和電子材料等。共沉淀法是目前制備納米Fe3O4的重要方法之一,其流程如圖所示:
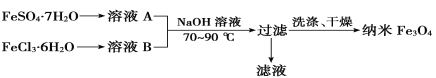
①為得到較純凈的納米Fe3O4,FeSO4·7H2O與FeCl3·6H2O的物質的量之比最好為________。但實際操作時,卻很難控制這一比例,原因是___________________________________________。
②在最佳投料比條件下,檢驗Fe3O4是否沉淀完全的實驗操作是_________________________。
(3)綠礬(FeSO4·7H2O)是治療缺鐵性貧血藥品的重要成分。測定綠礬產品中FeSO4·7H2O含量的方法如下:
a.稱取3.0 g綠礬產品,配制成250.00 mL溶液;
b.量取25.00 mL a中溶液于錐形瓶中;
c.用0.01000 mol·L-1酸性KMnO4溶液滴定至終點,消耗KMnO4溶液的平均體積為20.00 mL。滴定時發生反應的離子方程式為5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O。
①滴定終點的現象是_______________________________________________________________________。
②產品中FeSO4·7H2O的質量分數為________(小數點后保留1位數字)。
③若用上述方法測定的樣品中FeSO4·7H2O的質量分數偏低(測定過程中產生的誤差可忽略),可能的原因有________________________________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在劇烈運動或過熱出汗后,及時補充電解質對保持健康很重要,下列關于電解質的說法錯誤的是
A.酸、堿、鹽都是電解質
B.電離時產生的陰離子只有OH-的電解質是堿
C.在水溶液中或熔融狀態下能導電的化合物是電解質
D.由于氧化鈉溶于水生成鈉離子和氫氧根離子,因而氧化鈉是電解質
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學小組實驗探究KI和FeCl3生成KCl、I2和FeCl2的反應存在一定限度。
實驗:i.向5mL0.1mol/L KI溶液中滴加5~6滴0.1mol/L FeCl3溶液。充分反應后,將所得溶液分成甲、乙、丙三等份;
ⅱ.向甲中滴加CCl4,充分振蕩;
ⅲ.向乙中滴加試劑X。
(1)將KI和FeCl3反應的離子方程式補充完整。_____I-+___Fe3+![]() ______I2+_______Fe2+
______I2+_______Fe2+
(2)步驟ⅲ中,試劑X是_____________。
(3)步驟ⅱ和ⅲ的實驗現象中,能說明①中反應存在一定限度的實驗現象是_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下列敘述寫出相應的熱化學方程式:
(1)已知16 g固體硫完全燃燒時放出148.4 kJ的熱量,寫出表示硫的燃燒的熱化學方程式_____________________________________。
(2)如圖是298 K、101 kPa時,N2與H2反應過程中能量變化的曲線圖。該反應的熱化學方程式為_______________________________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在密閉容器中發生下列反應:I2(g)+H2(g) ![]() 2HI(g)(正反應吸熱)。起始時,n(H2)=a mol,n(I2)=b mol。只改變表中所列出的條件,其他條件不變,試將化學反應速率的改變(“增大”、“減小”或“不變”)填入相應的表格。
2HI(g)(正反應吸熱)。起始時,n(H2)=a mol,n(I2)=b mol。只改變表中所列出的條件,其他條件不變,試將化學反應速率的改變(“增大”、“減小”或“不變”)填入相應的表格。
編號 | 反應條件 | 反應速率 |
(1) | 降低溫度 | ____________ |
(2) | 加入催化劑 | _____________ |
(3) | 再充入a mol H2 | _____________ |
(4) | 將容器容積擴大為原來2倍 | ___________ |
(5) | 通入b mol Ne(g) | __________ |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】信息時代產生的大量電子垃圾對環境造成了極大的威脅。某“變廢為寶”學生探究小組將一批廢棄的線路板簡單處理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金屬的混合物,并設計出如下制備硫酸銅晶體的路線:

回答下列問題:
(1)第①步Cu與酸反應的離子方程式為_______________________________________;得到濾渣1的主要成分為________________。
(2)第②步加入H2O2的作用是______________________________________,使用H2O2的優點是______________________________________________;調節pH的目的是使_______________生成沉淀。
(3)用第③步所得CuSO4·5H2O制備無水CuSO4的方法是_______________________。
(4)由濾渣2制取Al2(SO4)3·18H2O,探究小組設計了三種方案:
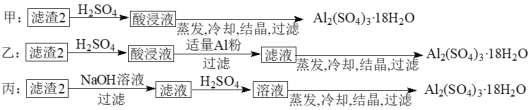
上述三種方案中,______方案不可行 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有甲、乙兩個裝置,下列說法錯誤的是( )
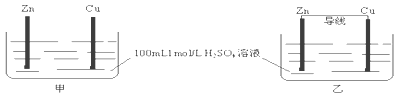
A. 甲、乙裝置中,Zn的質量均減小B. 甲、乙裝置中,Cu上均有氣泡產生
C. 化學反應速率乙>甲D. 甲中H+移向Zn,乙中H+移向Cu
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com